Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 159 questões
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A curva resultante da plotagem do logaritmo neperiano da
concentração do H2O2 em função do tempo de reação resulta
em uma reta com inclinação negativa.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


A partir do gráfico apresentado e de acordo com a equação de Arrhenius, é possível determinar que a energia de ativação da reação é superior a 1,0 × 105 J × mol-1 .


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2
decompostas é maior na reação realizada em presença do
catalisador do que na reação não catalisada.
A + 3B → 2C + D
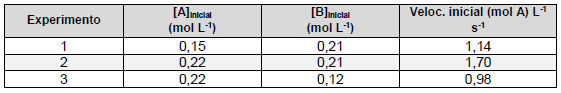
A partir dessas informações, considere as seguintes afirmativas:
1. A reação é de primeira ordem em relação ao reagente A, e também de primeira ordem em relação ao reagente B. 2. A lei de velocidade da reação, baseada na estequiometria da reação, é velocidade = k [A][B]3 , e a ordem global da reação é 4. 3. A lei de velocidade da reação, baseada nos dados experimentais, é velocidade = k [A][B], e a ordem global da reação é 2. 4. O valor de k para o experimento 2 é 36,79 L mol-1 s -1 .
Assinale a alternativa correta.
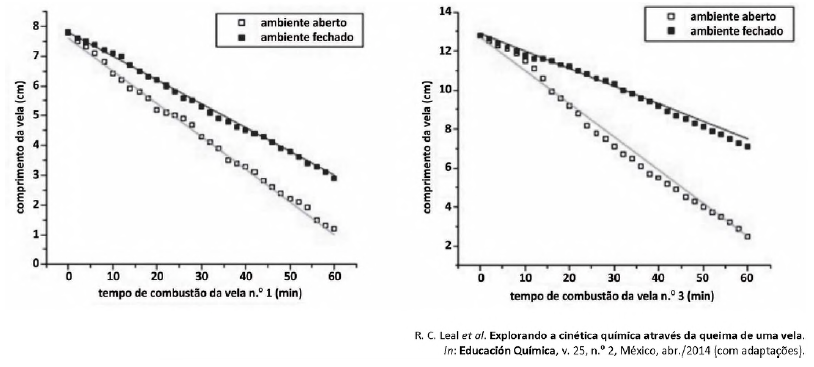
Acerca da variação na velocidade de queima das velas, assinale a alternativa correta.
A reação química genérica
2A(g) ⇋ B(g) + C(g) tem como expressão
de lei velocidade a 75°C 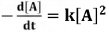 em que [A] é a concentração de A, em
mol/L, k é a constante de velocidade
dessa reação. Se [A]0 denota a
concentração inicial de A no instante
t = 0, então a concentração de A, em
qualquer instante t, pode ser calculada
por meio da expressão
em que [A] é a concentração de A, em
mol/L, k é a constante de velocidade
dessa reação. Se [A]0 denota a
concentração inicial de A no instante
t = 0, então a concentração de A, em
qualquer instante t, pode ser calculada
por meio da expressão
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
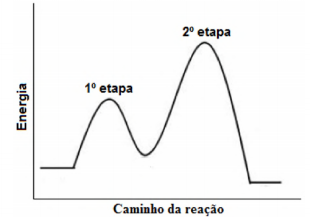
Em relação ao tema, assinale a alternativa
correta.
Considere a reação química genérica representada por x → Z , cujo gráfico da concentração de X em função do tempo é mostrada na seguinte figura.
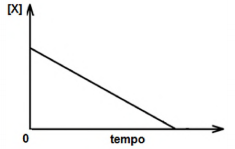
Em relação ao tema, analise as asserções a seguir:
A velocidade de consumo da substância X permanece constante durante todo o processo da reação.
PORQUE
A reação dada tem ordem global zero.
Referente às asserções, é correto
afirmar que
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A velocidade de formação de Z, em
unidades do SI, quando as concentrações
de X e Y forem iguais a 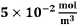 e
e 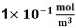 , respetivamente, é igual a
, respetivamente, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A constante de velocidade da reação,
em unidades do SI, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A ordem global da reação é igual a
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
De acordo com a teoria das colisões, um aumento na
temperatura de reação ocasiona aumento no número total de
colisões entre as espécies reagentes e na fração de colisões
efetivas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O efeito da adição do catalisador ácido é o de reduzir a energia
de ativação da reação e, com isso, aumentar a fração de
colisões efetivas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação
seja alcançado mais rapidamente; quando alcançado, o
equilíbrio estará mais deslocado para o sentido dos produtos.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
Se a reação de desidratação de um alqueno ocorre de acordo com uma cinética de pseudoprimeira ordem, então o gráfico da concentração do alqueno em função do tempo terá aspecto conforme indicado no gráfico a seguir.
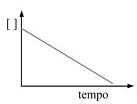
Considere que um técnico de laboratório busque maneiras de melhorar o processo pela qual o minério de ferro, contendo Fe2O3 , é convertido em ferro. Em seus testes, ele realizou a seguinte reação em pequena escala.
Fe2O3 (s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Nessas condições, admitindo que há 150 g de Fe2O3 como reagente limitante, qual é aproximadamente o rendimento teórico de ferro?
Em um recipiente, à temperatura constante, ocorre o seguinte equilíbrio, cuja reação não se encontra balanceada:

Irá provocar deslocamento do equilíbrio, no sentido da
formação de produtos, a: