Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 305 questões
Uma amostra de minério (20,00 g) foi previamente solubilizada com uma mistura de ácidos inorgânicos e posteriormente diluída com água para ajustar seu volume para 1,00 L. Dessa solução, separam-se 250,00 mL que foram colocados em uma célula de um sistema eletrogravimétrico. Após a aplicação de um potencial adequado, o cobre da solução foi depositado, seletivamente, na superfície de um eletrodo de platina (em forma de rede para se ter elevada área superficial).
Se a massa de cobre depositada no eletrodo foi igual a 1,55 g, a percentagem (m/m) no minério é
O enxofre do H2S dissolvido em água pode ser precipitado por um processo eletrolítico, como indicado na equação a seguir.
H2 S(aq) + I2(aq) → S(s) + 2H+ (aq) + 2I- (aq)
Considere os seguintes potenciais normais de redução, de três metais genéricos X, Y e Z, respectivamente:
X2+ + 2 e- → X° E° = - 0 ,7 5 V
Y2+ + 2 e- → Y° E° = + 0 ,3 5 V
Z+ + e- → Z° E° = + 0 ,8 0 V
Assinale a alternativa que apresenta o melhor agente oxidante.
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
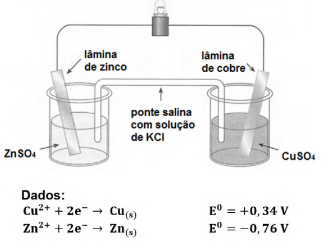
Acerca da situação apresentada, assinale a alternativa INCORRETA.
O potencial padrão de redução do Fe3+ (ver equação I) é +0,77 V em relação ao eletrodo padrão de hidrogênio (EPH). O eletrodo de referência de calomelano, ou Hg/Hg2Cℓ2 (KCℓsat), tem potencial de redução (ver equação II) igual a +0,24 V em relação ao EPH.
I - Fe3+ (aq) + e → Fe2+ (aq) E° = +0,77 V
II - Hg2Cℓ2(s) + e → 2 Hg(ℓ) + 2 Cℓ- (aq) E° = +0,24 V
Assim sendo, o potencial de redução padrão do Fe3+, em V, em relação ao eletrodo de referência de calomelano é
Em uma pilha Ni0 |Ni2+||Cu2+|Cu0 , os metais estão mergulhados em soluções aquosas 1,0 M de seus respectivos sais a 25ºC.
O valor da força eletromotriz (f.e.m) da pilha, em V, é

Considere os elementos abaixo e seus potenciais de redução listados.
Al3+ + 3e- → Al E0 (red) = -1,67 V
Mn2+ + 2e- → Mn E0 (red) = -1,18 V
Zn2+ + 2e- → Z n E0 (red) = -0,76 V
Ni2+ + 2e- → Ni E0 (red) = -0,23 V
Cu2+ + 2e- → Cu E0 (red) = +0,34 V
Assinale a alternativa que corresponde ao par dos
metais listados que, ao se construir uma pilha com
eles, apresentarão a menor diferença de potencial.
Sobre a bauxita, que é utilizada como principal fonte de extração do alumínio metálico, analise as afirmativas a seguir e assinale a alternativa correta.
I. É uma mistura de óxidos de óxidos de alumínio, principalmente Al2O3, sendo abundante na natureza.
II. A extração do alumínio metálico, a partir desse óxido, envolve um processo de redução eletroquímica.
III. A dificuldade de extração do alumínio desse material fez com que o alumínio metálico, embora seja o metal mais abundante na crosta terrestre, só passasse a ser utilizado amplamente a partir do século XIX.
Estão corretas as afirmativas:
Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química:
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Pode-se realizar a determinação de chumbo nas amostras por
meio de um sistema eletroquímico composto por um eletrodo
de referência prata-cloreto de prata e um eletrodo indicador de
primeira classe constituído de uma placa de chumbo.
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.