Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 534 questões
Dados: potenciais padrão de redução das semirreações:
Zn2+ (aq) + 2 e− ⟶ Zn (s) E0 = −0,76 V Bi3+ (aq) + 3 e− ⟶ B (s) E0 = +0,20 V
A célula eletrolítica para purificação do cobre contém solução de sulfato de cobre (CuSO4), o material a ser purificado em um dos eletrodos e outro eletrodo onde se depositará o cobre puro, como representado a seguir:
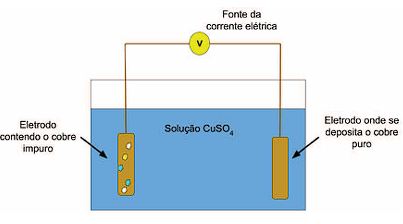
Disponível em: <https://www.saofranciscodeassis.edu.br/rgsn/arquivos/RGSN04/Refino-do-cobre-por-meio-daeletr%C3%B3lise-DAROSCI-OLIVEIRA-p171-182.pdf> (Com adaptações). Acesso em: 17 abr. 2024.
Sobre essa metodologia, é correto afirmar que:
Em uma turma de Ensino Médio, o professor resolveu confeccionar uma bateria com materiais de baixo custo, para fins didáticos. Utilizando recipientes coletores, pregos galvanizados, pedaços de grafite e tintura de iodo contendo um pouco de iodeto de potássio, três células galvânicas foram montadas e associadas em série, como visto na figura abaixo:
Os alunos foram convidados a medir a tensão gerada pela bateria com auxílio de um multímetro.
DE ARAÚJO, Sayonara Maria Ferreira et al. Confecção de celas galvânicas com materiais de baixo custo para otimização de aulas sobre reações de oxirredução e eletroquímica no ensino médio. (Com adaptações).
Dados:
Potenciais de redução nas condições em que a bateria foi confeccionada:
I3- + 2e- → 3I- E = 0,53V
Zn+2 + 2e- → Zn E = -0,76V
Qual é o valor mais próximo do esperado para a bateria descrita?
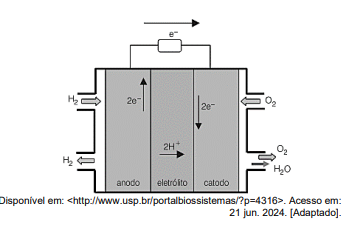
A figura acima mostra o esquema de funcionamento de uma célula operando com H2 como combustível. Analisando o esquema, durante funcionamento deste dispositivo,
ER║HA, CA│Pt, H2 (1 atm)
Dados:
ΔE = Ec – Ea
Ka = [H3O+] . [A–] / [HA]
E = E0 – (0,0592 / n). log ([Red.] / [Oxid.]), em que “Red.” é a espécie reduzida, e “Oxid.”, a oxidada.
Com relação ao exposto, assinale a alternativa que expressa corretamente a relação entre Ka e ΔE.
Assinale a opção que corresponde a um dos fenômenos que acontece na célula.
As bactérias redutoras de sulfato (BRS) têm grande importância na biocorrosão. Embora, até o momento não exista a determinação de um mecanismo único de corrosão ocasionado pela ação das BRS, Kuhr e Vlug (1934) propuseram um mecanismo no qual essas bactérias utilizam o hidrogênio proveniente do consumo realizado pela hidrogenase, catalisando a ativação reversível de hidrogênio. Em condições anaeróbicas, essa reação de corrosão é a evolução de hidrogênio pela dissociação da água, em que os íons de hidrogênio produzidos se encontram adsorvidos sobre a superfície metálica, sendo posteriormente consumidos pelo processo metabólico, como mostra a figura abaixo:
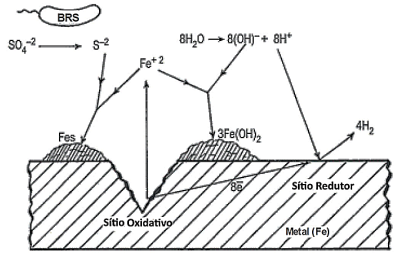
De acordo com o que mostra a figura e a descrição do mecanismo de corrosão supracitado, esse tipo de biocorrosão é classificado como
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Potencial de eletrodo é a medida do potencial individual de
um eletrodo reversível no estado-padrão, ou seja, solutos em
concentração de 1 mol/kg e gases à pressão de 1 bar, ambos
a 273 K.
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Para determinar a capacidade de um metal em atuar como anodo de sacrifício, é adequado montar um eletrodo com o referido metal, com potencial desconhecido, ligá-lo a um eletrodo de potencial conhecido e medir a diferença de potencial entre os eletrodos. Nesse contexto, pode-se usar, para a avaliação, um eletrodo de zinco metálico (Zn), que, em uma célula eletroquímica com solução 1 mol/L de ZnSO4, apresenta a seguinte semirreação no anodo.
Zn (s) → Zn2+ (aq) + 2 e−
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
A equação de Nernst tem por finalidade prever o potencial
de uma pilha durante o seu funcionamento, correlacionando
a variação do potencial da pilha em certo instante da reação
com a variação das concentrações de produtos e reagentes.
Uma corrente elétrica que percorre um condutor gera, em torno desse condutor, um campo magnético com direção determinada pela regra da mão esquerda.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Supondo que todo o oxigênio produzido na eletrólise seja
lançado na atmosfera, então, a 1 atm de pressão e 298 K de
temperatura, uma tonelada de água submetida à eletrólise
lançará mais de 500.000 L de oxigênio na atmosfera.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Uma tonelada de água produzirá menos de 120 kg de
hidrogênio em uma eletrólise.
Julgue o seguinte item, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
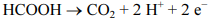
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 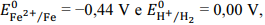 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.