Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 534 questões
- O ar expelido pelos pulmões do suspeito é bombeado em uma solução de dicromato de potássio fortemente acidulada (ácido sulfúrico); - O etanol presente na boca do motorista (se este consumiu bebida alcoólica) reage com os íons dicromato da solução, produzindo acetaldeído e íons Cromo (III); - Em razão da reação química, ocorre uma mudança na cor da solução, a cor característica laranja passa para um tom esverdeado, acusando a presença de álcool etílico ou etanol.
Adaptado. Composição química do Bafômetro - Mundo Educação (uol.com.br). (Acesso em 23 de Julho de 2021)
A reação que ocorre no bafômetro com dicromato de potássio está representada pela equação química não balanceada a seguir:
K2Cr2O7(aq) + x H2SO4(aq) + 3CH3CH2OH(g) → alaranjado incolor
Cr2(SO4)3(aq) + y H2O(l) + 3CH3CHO(g) + K2SO4(aq) verde incolor
Assinale a alternativa que relaciona a classificação e os respectivos valores de x e y (mínimos coeficientes inteiros) que balanceiam corretamente a reação do bafômetro com dicromato de potássio.
Disponível em: <http://cfq.org.br/noticia/>. Acesso em: 3 mar. 2021, com adaptações.
Com base nessas informações, é correto afirmar que a eletrólise consiste em um processo
I. A eletrólise é um processo no qual o trabalho elétrico gera a reação química.
II. Se o cloreto de sódio for submetido a uma eletrólise ígnea ou aquosa, os produtos dessa reação são os mesmos: sódio metálico e gás cloro.
III. Na eletrólise em meio aquoso, quem irá definir a ordem de descarga dos íons é o potencial de redução padrão, E°red, de cada substância durante esse processo.
IV. A quantidade formada de produtos eletroquímicos será definida pela primeira lei de Faraday.
É CORRETO o que se afirma em
4 Ag(s) + O2(g) + 4 H+ (aq) → 4 Ag+ (aq) + 2 H2O(l)
Com base nessa reação, o valor da variação de energia livre de Gibbs padrão (ΔG0) é, aproximadamente, igual a
Dados: E0 Ag+/Ag0 = −0,80 V; E0 O2(g)/H2O = 1,23 V; Constante de Faraday (F) = 96500 C mol-1
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
O termo pilha é empregado para se referir a um
dispositivo constituído de dois eletrodos e um eletrólito,
arranjados de maneira a produzir energia elétrica.
Quando os eletrodos são conectados a um aparelho
elétrico, uma corrente flui pelo circuito, pois o material
de um dos eletrodos oxida-se espontaneamente,
liberando elétrons (ânodo), enquanto o material do
outro eletrodo reduz-se, usando esses elétrons (cátodo).
Sabendo-se que o equivalente eletroquímico da prata é 1,118mg/C, o tempo foi de cerca de:
Um metal que tenha sofrido processo corrosivo por formação de trincas microscópicas ao longo do contorno dos grãos da estrutura metalúrgica, sem alteração significativa nas dimensões da peça, foi vítima de corrosão:
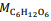 = 180 g/mol e
= 180 g/mol e 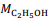 = 46 g/mol.
= 46 g/mol. De acordo com os experimentos de Faraday, a quantidade de produto formado ou de reagente consumido em uma reação eletrolítica é estequiometricamente proporcional à diferença de potencial aplicada entre os eletrodos da célula eletrolítica.
A alternativa que apresenta os coeficientes estequiométricos na ordem a, b, c, d, e, f, g que respeitam a reação de oxirredução a seguir é:
a KMnO4 + b H2S + c HCl
→ d MnCl2 + e S + f H2O + g KCl
luz e clorofila 6 H2O (I) + 6 CO2 (g) → C6H12O6 (aq) + O2 (g)
Sobre essa reação química, é correto afirmar:
1- Pilha seca comum
( ) Não forma amônia como camada isolante.
2- Pilha alcalina
( ) Sua semirreação catódica é:
2 Ni(OH)3 (s) + 2e → 2 Ni(OH)2 (s) + 2 OH– (aq)
3- Pilha de mercúrio
( ) Emprega sais dissolvidos em solventes não aquosos.
4- Bateria de hidreto metálico
( ) Contém pasta úmida de ZnCl2, NH4Cl e H2O.
5- Bateria de íons lítio
( ) É adequada para dispositivos sensíveis, como aparelhos desurdez, instrumentos científicos e relógios.
Assinale a sequência correta.
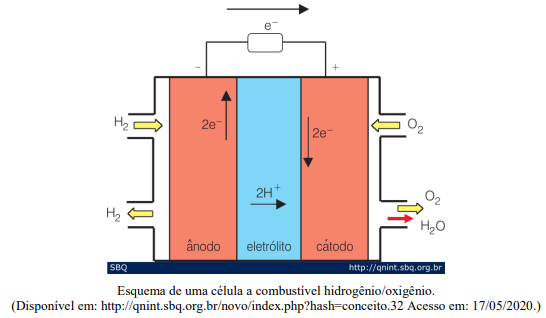
Levando em consideração o funcionamento de uma célula a combustível esquematizado acima, marque V para as afirmativas verdadeiras e F para as falsas.
( ) As células a combustível são células galvânicas nas quais a energia de Gibbs de uma reação química é transformada em energia elétrica (por meio da geração de uma corrente). ( ) A principal semelhança em relação às pilhas e baterias é o fato de, nas células a combustível, os reagentes já estarem armazenados no interior do sistema. ( ) Devido à dificuldade de se armazenar H2, uma alternativa para alimentação das células a combustível é o metanol, que, por sua vez, apresenta a desvantagem de gerar CO e/ou CO2 que são gases de efeito estufa. ( ) O combustível é reduzido de forma contínua no ânodo, enquanto oxigênio é oxidado no cátodo, produzindo água como produto final e energia elétrica.
Assinale a sequência correta.
MnO4 - (aq) + 5Fe2+ (aq) + 8H+ (aq) → Mn2+ (aq) + 5Fe3+ (aq) + 4H2O(l)
Em relação a essa equação química, verifica-se que o
O alumínio já foi o metal mais caro do mundo. Por isso, Napoleão disponibilizava talheres e pratos de alumínio para convidados especiais nos banquetes, enquanto os menos favorecidos usavam de ouro. Em 1855, o norte-americano Charles Martin Hall e o francês Paul Louis Toussaint Héroult descobriram e patentearam quase simultaneamente um processo de obtenção de alumínio a partir do minério bauxita, rico em óxido de alumínio.
KEAN, Sam. A colher que desaparece: Editora Zahar, 2011 (adaptado).O processo ficou conhecido como Hall-Heróult e permitiu o estabelecimento da indústria global do alumínio, cuja obtenção ocorre por meio de:
“A maior ameaça à camada de ozônio no século XXI é o gás hilariante (N2O - óxido nitroso). Segundo o Pnuma (Programa das Nações Unidas para o Meio Ambiente), análises de cientistas de 35 organizações revelaram que o N2O, agora, é o gás mais importante a exaurir o ozônio e o terceiro mais poderoso gás do aquecimento global emitido na atmosfera. Os níveis de N2O aumentaram nas últimas décadas, puxados sobretudo pelos processos de nitrificação e de desnitrificação dos fertilizantes nitrogenados no solo.”
Disponível em: <https://www.terra.com.br/noticias/ciencia/clima/onu-faz-soaroxido-nitroso-a-camada-de-VgnCLD2000000dc6eb0aRCRD.html>. Acesso em: 24 nov. 2020.
O mecanismo de destruição pode ser resumido pelas seguintes equações:
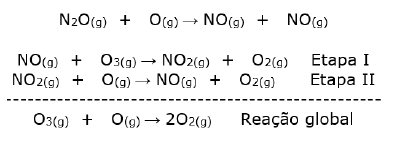
A classificação química do óxido nitroso e a função do NO no mecanismo de destruição do ozônio são, respectivamente:

A pilha que apresenta maior diferença de potencial padrão pode ser representada esquematicamente por: