Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 676 questões
Sobre a galvanização, afirma-se que
Considere as reações de redução e os respectivos potenciais apresentados a seguir.

O elemento que seria útil para a proteção do ferro é o
seguem.
seguem.
seguem.
seguem.
seguem.
da corrosão e dos materiais de construção de equipamentos
industriais, julgue os itens a seguir.

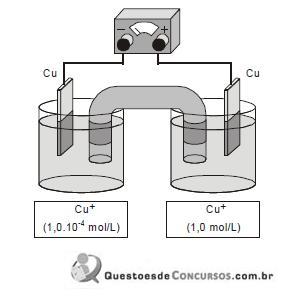
Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.

Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.

As associações corretas são
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.

PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura.
A esse respeito, conclui-se que
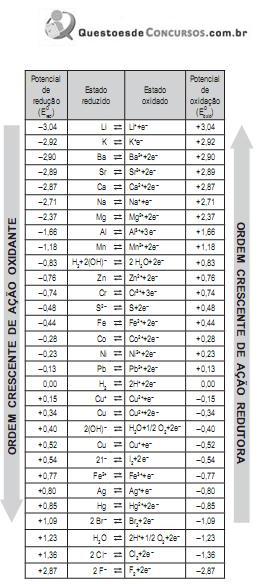
O cobre pode ser obtido por processamento hidrometalúgico de minérios ou concentrados. A rota usual consiste em lixiviação ácida, purificação por extração com solventes e obtenção final por eletrorredução do metal em soluções ácidas de sulfato de cobre. Com base na tabela acima, qual impureza prejudica significativamente a eficiência de corrente nessa última etapa do processo?
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
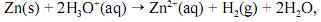
na qual o H+ é o agente oxidante.
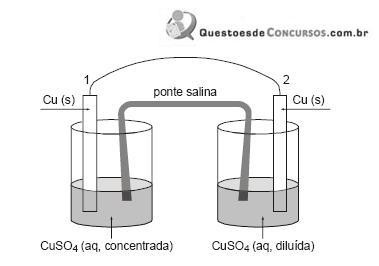
Durante o funcionamento dessa pilha eletroquímica, antes de atingir o equilíbrio, observa-se:
I. fluxo de elétrons de 1 para 2.
II. reação de redução do
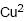 + em 2.
+ em 2. III. aumento da massa da placa de Cu (s) em 1.
É correto o que se afirma APENAS em
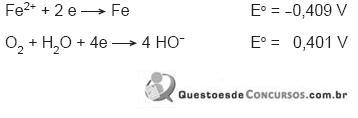
Considerando que a variação de energia livre de uma reação de oxidorredução pode ser calculada pela fórmula
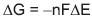 , na qual n é o número de elétrons transferidos, F é a Constante de Faraday
, na qual n é o número de elétrons transferidos, F é a Constante de Faraday 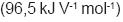 e
e 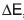 , a diferença entre os potenciais padrão das reações de oxidação e de redução, conclui-se que a(o)
, a diferença entre os potenciais padrão das reações de oxidação e de redução, conclui-se que a(o)
Em relação à pilha eletroquímica, formada por um eletrodo padrão de zinco ligado por um fio condutor a um eletrodo padrão de ferro e a uma ponte salina, é correto afirmar que, a/o