Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 659 questões
H2 O2 (aq) → H2 O(L) + ½ O2 (g),
é uma reação de oxirredução na qual o elemento
A corrosão química somente ocorre em meio aquoso, uma vez que há transferência de elétrons no meio.
A corrosão eletroquímica é um processo espontâneo no qual acontecem, simultaneamente, reações anódicas e catódicas.
A corrosão química ocorre apenas em metais.
A corrosão eletrolítica caracteriza-se por um processo eletroquímico, porém não espontâneo, uma vez que ocorre, com frequência, em tubulações de petróleo e em tanques de postos de gasolina, por meio da aplicação de uma corrente elétrica externa.
Considere o esquema de uma pilha constituída de duas semipilhas com metais mergulhados em soluções aquosas de seus íons (Zn em Zn(NO3) 2(aq) e Cu em Cu(NO3)2(aq)) e unidas por um tubo de vidro em U contendo um eletrólito em solução saturada (ponte salina), fios conectados aos metais e um voltímetro (V). Nesse sistema, ocorre uma reação espontânea representada por:
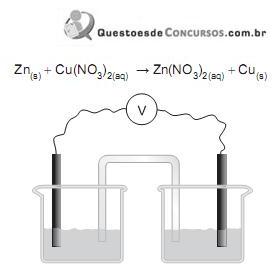
Nessa pilha

É correto APENAS o que se afirma em
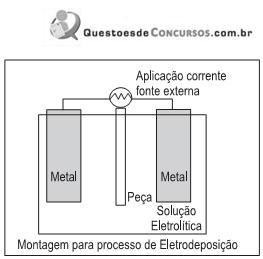
Esse processo consiste na aplicação de células eletrolíticas que utilizam energia elétrica para produzir reações de oxirredução não espontâneas, além de permitir o(a)
Fe (s) + O2 + H2 O (vapor) → Fe(OH)2 Fe(OH)2 + O2 (g) → Fe2 O3 H2 O (vermelha ou castanha) + H2 O
Fe(OH)2 → Fe3 O4 (preto)+H2 O +H2 Nas reações descritas pelas equações acima, observa-se que o ferro
Considerando-se a série de potenciais eletroquímicos apresentada, qual a diferença de potencial mínima, em V, que precisa ser aplicada entre os eletrodos para que a reação seja possível?
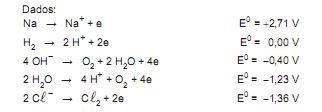
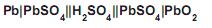
O que constitui o catodo desse tipo de bateria?
Com relação à proteção catódica galvânica de estruturas de aço-carbono em água do mar, é INCORRETO afirmar que a(s)
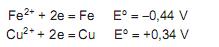
Na construção de um argumento que prove o erro cometido pela construtora, o Técnico em Química afirmou que,

