Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 659 questões
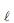 é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as)
é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as) K2 Cr 2 O7 (aq) + FeSO4 (aq) + H2 SO4 (aq) ? Cr 2 (SO4 ) 3 (aq) + Fe2 (SO4 ) 3 (aq) + K2 SO4 (aq) + H2 O
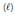
Nessa equação, verifica-se que
Qual a maior voltagem que se pode extrair desse artefato quando os materiais disponíveis são Zn, Fe e Ag?
Dados:
Zn2+ + 2e → Zn (Ered0 = -0,76 V)
Fe2+ + 2e → Fe (Ered0 = -0,44 V)
Ag+ + 1e → Ag (Ered0 = 0,80 V)
A partir dessa observação, conclui-se que os
Durante o uso (descarga) dessa bateria, como acontece quando se dá partida no automóvel, o
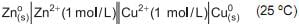
Sabe-se que o zinco pode ceder elétrons espontaneamente para os íons Cu2+.
A partir dessa afirmação, conclui-se que
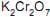 em água destilada com o volume sendo ajustado para 250,00 mL em balão volumétrico.
em água destilada com o volume sendo ajustado para 250,00 mL em balão volumétrico. A concentração da solução assim preparada, em mol/L, é igual a:
Dado:
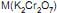 = 294 g/mol
= 294 g/mol O ponto final dessa titulação pode ser detectado por potenciometria, onde o potencial no ponto de equivalência em um sistema operando a 25 ºC e 1 atm é
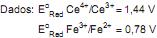
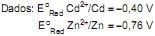
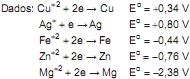
Considerando-se os métodos de galvanização e proteção catódica, observa-se que na(o)
Sobre a corrosão de superfícies metálicas tem-se que o(a)
I - ferro presente em construções, como pontes e portões, tende a se reduzir espontaneamente formando sal de ferro, que comumente é chamado de ferrugem.
II - água conduz melhor a eletricidade na presença de íons dissolvidos, logo, em regiões litorâneas, o processo de corrosão é favorecido.
III - presença de água favorece a formação de ferrugem, mas a ação do oxigênio não interfere no processo de corrosão.
IV - processo de corrosão se assemelha ao que ocorre numa pilha eletroquímica, onde estão envolvidas reações de oxirredução.
São corretas APENAS as afirmativas
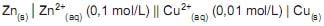
Assim, o valor calculado de potencial (ΔE) que mais se aproxima ao que a pilha desenvolveria nesse momento é
Dado: Potencial padrão (ΔE°) da pilha de Daniel é 1,10 V
O potencial padrão de uma célula formada por uma cela de Ag/Ag+ e uma de Cu/Cu 2+ é
PbO 2(s) + Pb (s) + 2 H 2 SO 4(aq) → 2 Pb SO 4(s)+ 2 H 2 O (l)
Na bateria, o polo negativo ou anodo da pilha é
Sobre corrosão, considere as afirmativas a seguir.
I - A água do mar é considerada um meio corrosivo, e o solo é considerado um meio inerte, não corrosivo.
II - A corrosão do ferro é um processo espontâneo e representa a tendência de formação de um produto mais estável.
III - A proteção catódica é uma escolha adequada para revestir superfícies metálicas passíveis de corrosão.
Está correto APENAS o que se afirma em
Dentre os eletrodos que devem ser usados como referência, NÃO se inclui o eletrodo
8 HI + H2 SO4 → H2 S + 4 H2 O + 4 I 2
Os elementos que sofrem oxidação e redução, respectivamente, são
HNO3 + I 2 → HIO3 + NO + H2 O
Sabendo-se que essa reação química é de oxirredução, afirma-se que os agentes oxidante e redutor são, respectivamente,