Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
H2 O2 (aq) → H2 O(L) + ½ O2 (g),
é uma reação de oxirredução na qual o elemento
A corrosão química somente ocorre em meio aquoso, uma vez que há transferência de elétrons no meio.
A corrosão eletroquímica é um processo espontâneo no qual acontecem, simultaneamente, reações anódicas e catódicas.
A corrosão química ocorre apenas em metais.
A corrosão eletrolítica caracteriza-se por um processo eletroquímico, porém não espontâneo, uma vez que ocorre, com frequência, em tubulações de petróleo e em tanques de postos de gasolina, por meio da aplicação de uma corrente elétrica externa.
O potencial de oxidação do ferro é mais alto do que o potencial de oxidação do
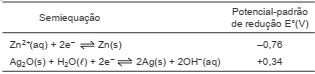
A pilha de zinco e óxido de prata é usada em aparelhos auditivos e relógios de pulso e são menos poluentes do que a de zinco e óxido de mercúrio.
Tendo em vista essas informações e os dados da tabela de
potencial-padrão de redução para as semiequações que
ocorrem nessa pilha, é correto afirmar:
Cr2O2-7 (aq) + Cℓ− (aq) + H+ (aq) → Cr3+(aq) + H2O(ℓ) + Cℓ2(g)
No balanceamento de equações de oxirredução, algumas espécies transferem elétrons para outras, de forma que, no final da reação química, o número de elétrons transferidos é igual ao de elétrons recebidos.
Com base nessas informações e após o balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
I. 2H+(aq) + 1/2O2(aq) + 2e- → H2O(ℓ) Eºred = + 1,23v
II. Fe3+(aq) + e- → Fe2+(aq) Eºred = +0,77
As soluções aquosas ácidas de sais de íons Fe2+(aq) são esverdeadas quando recém-preparadas e, quando em contato prolongado com o ar, tornam-se amareladas.
A partir dessas considerações e das semiequações I e II
com os respectivos potenciais-padrão de redução, é correto
afirmar:
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Utilizando-se medidas potenciométricas, a determinação de
chumbo requer, necessariamente, o uso de padrões com
concentrações conhecidas para construção de uma curva
analítica.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Pode-se realizar a determinação de chumbo nas amostras por
meio de um sistema eletroquímico composto por um eletrodo
de referência prata-cloreto de prata e um eletrodo indicador de
primeira classe constituído de uma placa de chumbo.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Quando são realizadas medidas com o eletrodo de vidro de
soluções muito ácidas, podem ser observados valores de pH
menores que os reais, que são conhecidos como erros ácidos.
Sua principal origem consiste na saturação da membrana de
vidro por íons H+
.
A corrosão é definida como a deterioração de um material, geralmente metálico, em virtude da ação do meio ambiente que o modifica por meio de um processo espontâneo. Isso pode acarretar a inutilização de estruturas de uso corrente no dia-adia.
É corrente vermos estruturas metálicas espalhadas por toda parte, seja nos meios de transporte como automóveis, caminhões, navios ou aviões, ou em gasodutos, adutoras, entre outros. Todos esses objetos ou aplicações metálicas sofrem a ação do meio, tornando-se, com o passar do tempo e com a corrosão, inadequados ao seu uso, com grandes prejuízos.
(Fonte: http://www.searadaciencia.ufc.br/sugestoes/quimica/quimica003.htm.)
A corrosão do ferro pode ser descrita pela reação:
KMnO4(aq) + SnSO4(aq) + H2SO4(aq) → MnSO4(aq) + Sn(SO4)2(aq) + K2SO4(aq) + H2O( l)
Considere as afirmações abaixo sobre essa reação.
I - MnO4 - é o agente oxidante no meio ácido, e Sn2+ , o agente redutor.
II - No balanço de massa, 2 mol de KMnO4 reagem com 5 mol de SnSO4 .
III - Sn2+ ganha 2 elétrons do MnO4 - ao passar para Sn4+ .
É correto APENAS o que se afirma em

