Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 659 questões
Indique o elemento que sofre oxidação e aquele que sofre redução.

Sobre essa reação, afirma-se que o
Abaixo estão representadas as semirreações do alumínio e do cobre com seus respectivos potenciais normais de redução.


A massa total de cobre, em gramas, que se deposita no catodo, durante o processo, é
Dado: mCu = 63,5 u
PbO2(s) + Pb(s) + 2 H2 SO4(aq)
→
2 PbSO4(aq) + 2 H2 ONessa reação de oxirredução, o
Basicamente, uma pilha eletroquímica tem os componentes mencionados a seguir, que apresentam as seguintes características:
2 H+ + 2 e → H2
H2 O→2 H+ + ½ O2 + 2 e
Considere as seguintes afirmativas:
I – Os potenciais normais de eletrodo são independentes do pH.
II – A diferença de potencial normal da célula é independente do pH.
III – Os sobrepotenciais são independentes da composição da solução.
De acordo com o exposto acima, está correto o que se afirma em
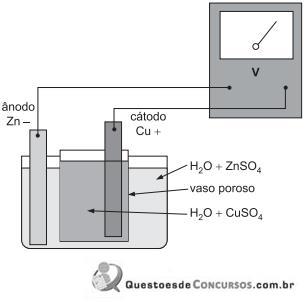
Disponível em: http://www.cis.udel.edu/*portinoi/academic/academic? les/daniellcell.html
A figura acima representa, esquematicamente, uma pilha de Daniel.
Admitindo-se concentrações (atividades) normais (1,0 M) dos sais, qual a leitura, em V, indicada pelo medidor de força eletromotriz?
As lacunas desse texto são, correta e respectivamente, preenchidas por:
A pilha de Daniell é representada pelo seguinte diagrama de célula:

Os experimentos de Alessandro Volta impulsionaram o estudo das pilhas, tendo ele montado a primeira pilha voltaica.
Na pilha de Daniell, o zinco oxida no cátodo, polo positivo da pilha.
I - É função do revestimento impedir a mistura do material da alma metálica com o metal de solda.
II - É função do revestimento a remoção dos elementos de liga do metal de solda.
III - É função do revestimento o isolamento mecânico da alma metálica.
É correto APENAS o que se afirma em
Na reação de oxirredução representada pela equação não balanceada acima, o número de oxidação médio do.

Com respeito a essa propriedade, o(a)
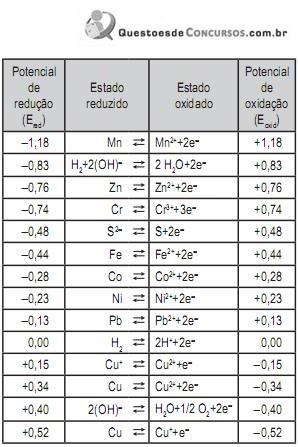
Utilize as informações contidas na Tabela de potenciais de redução abaixo para responder a questão.
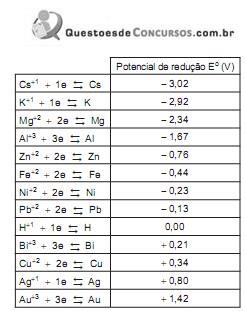
Considere a pilha abaixo representada pela seguinte equação:

Considerando o valor da constante de Faraday igual a 96.500 C, e que essa é a quantidade de carga elétrica de 1 mol de elétrons, qual é a quantidade máxima, em gramas, de sódio metálico que se forma, com a carga elétrica de 386.000 C, na eletrólise ígnea do NaCl?
Dado
M(Na) = 23 g/mol