Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Bi2 O3 + NaClO + NaOH → Na BiO3 + NaCl + H2O
Dados: 1 mol de elétrons = 96500 C (1 F), massa molar do Al = 27g.mol -1
Dados:
Zn 2+(aq) + 2è → Zn(s) E0 = - 0,76V
2H+(aq) + 2è → H 2(g)E0 = 0,00V
I. O oxigênio pode comportar-se como acelerador do processo eletroquímico de corrosão.
II. A corrosão eletroquímica será tanto mais intensa quanto maior o valor de pH.
III. Na corrosão eletroquímica, o metal se oxida num lugar, o oxidante se reduz em outro e o produto de corrosão se forma em regiões intermediárias, não apresentando características protetoras.
Está(ão) correta(s) a(s) afirmativa(s)
Na proteção com metal de sacrifício, o material a ser protegido é conectado como ânodo de uma célula galvânica, sendo o cátodo um metal mais ativo que se consome à medida que protege o material.
Há casos benéficos de corrosão, como a oxidação de aços inoxidáveis, que produz uma camada protetora de óxido de cromo, e a proteção do material de alumínio, com a formação de óxido de alumínio.
Considerando os potenciais de oxidação mostrados a seguir, é correto afirmar que a limpeza de aço inoxidável com cloro pode ser recomendada por impedir a corrosão devido ao menor potencial de oxidação (E) do ferro (Fe) em relação ao cloro
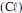 .
.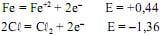
 operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de  . Considerando que a massa molar do
. Considerando que a massa molar do 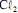 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.Na eletrólise da solução aquosa de
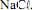 a formação do
a formação do 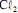 ocorre no ânodo da célula.
ocorre no ânodo da célula.  operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de  . Considerando que a massa molar do
. Considerando que a massa molar do  seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.O tempo necessário para a formação de 709 g de
 , a partir da eletrólise da solução aquosa de
, a partir da eletrólise da solução aquosa de  , é superior a 2 h.
, é superior a 2 h. O gráfico a seguir relaciona a porcentagem de atenuação total e a energia do fóton para o elemento carbono. (Tauhata et al, 2003.)
Com base nos dados do gráfico anterior, marque V para as afirmativas verdadeiras e F para as falsas.
( ) 1,0 MeV equivale a 1.000 elétrons‐volt.
( ) À medida em que a energia cresce, o efeito Compton (A) diminui e o efeito fotoelétrico (B) aumenta.
( ) Para valores de energia acima de 1,0 MeV, observa‐se que o efeito fotoelétrico (B) ainda se mantém superior ao efeito Compton (A).
( ) Observa‐se que, para valores de energia acima de 100 MeV, a produção de pares (C) passa a ser a principal contribuição para as interações de fótons.
A sequência está correta em
A fabricação do gás cloro a partir da eletrólise de uma solução de cloreto de sódio pode ser representada pela seguinte equação química: 2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2. Qual a massa, em kg, de gás cloro que é obtida a partir de 10 m3 de salmoura contendo 10% em massa de NaCl?
Dados: massa específica da salmoura = 1072 kg m-3 e as massas atômicas, em kg kmol-1, H = 1, O = 16, Na = 23 e Cl = 35,5
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
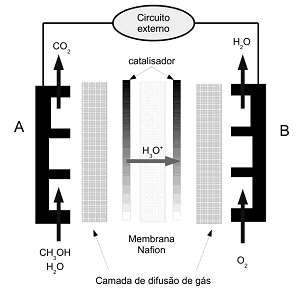
A DMFC (esquematizada na questão anterior) apresenta uma alta eficiência, porém reações paralelas causam quedas na tensão.
Dados: E0 298K (V): CO2/CH3OH = 0,02; O2/H2O = 1,23; 2,303.RT/F = 0,059.
Considerando que o valor do quociente da reação global da célula alcance uma ordem de 1060, o valor do potencial da célula em volts será de:
Células a combustível vêm atraindo a atenção por diversas vantagens, tais como alta eficiência, dimensões pequenas, facilidade de alimentação e longos tempos de operação. Entre as células, a célula de alimentação direta, a metanol (DMFC), esquematizada ao lado, é uma das mais úteis e flexíveis. Sobre o assunto, considere as seguintes afirmativas:
1. No esquema da DMFC, A e B correspondem ao anodo e catodo, respectivamente.
2. A corrente no circuito externo percorre o sentido de A para B.
3. O metanol precisa atravessar a camada de difusão de gás para que a reação ocorra.
4. A membrana de nafion corresponde a um condutor protônico e tem função análoga à ponta salina de uma pilha.
Assinale a alternativa correta.
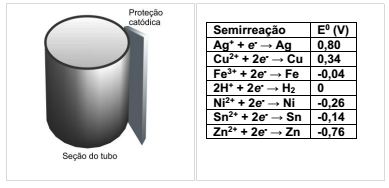
Tubulações de ferro, quando em contato com solo úmido, sofrem pela ação do meio, causando a corrosão da peça. Uma maneira de proteção da tubulação é a proteção catódica, isto é, a utilização de um metal de sacrifício em contato com a tubulação, como esquematizado ao lado:
Entre os metais listados abaixo, o mais adequado para compor a peça de proteção é:
Ao adicionar cloro gasoso sob pressão numa solução alcalina, o cloro se desproporciona em cloreto e hipoclorito, segundo a reação:

Dados: E0 pH 14 (V): Cl2/Cl- = 1,358; ClO- /Cl2 = 0,421; 2,303.RT/F = 0,059.
A ordem de grandeza da constante de equilíbrio da reação de desproporcionamento é:
