Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
I. A forma de corrosão denominada uniforme se processa em toda a extensão da superfície, ocorrendo perda uniforme da espessura. II. Todos os metais estão sujeitos ao ataque corrosivo se o meio for sufcientemente agressivo. III. Os metais ouro e prata não sofrem nenhum tipo de corrosão. Está correto o que se afirma em:
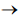 MnO2.H2O + (NH4)2SO4
Nessa reação química, o
MnO2.H2O + (NH4)2SO4
Nessa reação química, o I . Sempre envolve processos de óxido-redução. II . Cátodo é o eletrodo em que ocorre a redução. III . Polo negativo é aquele que libera elétrons para o circuito externo.
Está(ão) CORRETA(S) a(s) afirmativa(s):
2Fe(s) + O2(g) + 2H2O → 2Fe(OH)2(s)
Com base nas informações acima, é possível afirmar que:
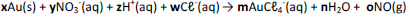
Onde x, y, z, w, m, n e o são coeficientes estequiométricos. Sobre essa reação assinale a alternativa CORRETA:
Qual o potencial da célula, em V, para o processo eletroquímico no qual o ferro pode reduzir os íons prata?

O texto a seguir foi adaptado de Quim. Nova, v. 39, 732- 740, 2016.
“Nos ambientes aquáticos, a concentração de fosfatos na coluna de água é dependente de alguns fatores, como o par redox Fe(II)/Fe(III), uma vez que nas camadas superficiais sua associação com os oxi-hidróxidos de Fe(III) formam compostos que apresentam baixa solubilidade e migram para camadas mais profundas (sedimento). Nessas camadas os oxi-hidróxidos de Fe(II), mais solúveis que os compostos de Fe(III, são formados, com a liberação do fosfato, estabelecendo um ciclo onde o fósforo migra novamente para as camadas superficiais.”
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Agente oxidante é uma espécie que fornece elétrons a
uma substância que está sendo reduzida (e ela própria
sendo oxidada) em uma reação de oxirredução. Agente
redutor é a espécie que remove elétrons da espécie que
está sendo oxidada (e ele próprio é reduzido) em uma
reação de oxirredução.
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Eletroquímica é o ramo da química que trata do uso de
reações químicas para produzir eletricidade, das forças
relativas dos agentes oxidantes e redutores e do uso da
eletricidade para produzir mudança química.
(Dados: Potenciais-padrão de redução: Fe2+ = - 0,44 V; Pb2+ = - 0,13 V. Massas molares em g/mol: Fe: 56; Pb: 207.)

Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
O estado de equilíbrio da reação de uma pilha recarregável
é deslocado pela passagem de corrente elétrica.
Um estudante do curso técnico em química utilizou um béquer de 100 mL ao qual adicionou solução de cloreto de sódio 3% e, logo após, fez a imersão parcial de uma lâmina de cobre conectada a uma lâmina de zinco por um fio condutor como ilustrado abaixo.
Dados:
I) Zn2+(aq) + 2e- → Zn(s) ____________________Eo = - 0,76 V
II) H2O(l) + O2(g) + 2 e- → 2 OH- (aq) ____________Eo = + 0,40 V
É CORRETO afirmar que:
Mesmo em sua simplicidade, a bateria de Volta possibilitou algumas descobertas importantes no campo da eletroquímica: a bioeletroquímica, devido ao debate entre Galvani e Volta, a eletroposição e outras mais. Analise as afirmativas seguintes, relacionadas eletroquímica e marque a alternativa CORRETA.
I. Quando uma espécie química perde elétrons para outra espécie química, ocorre redução.
II. Quando uma espécie química retira elétrons de outra espécie química, ocorre oxidação.
III. O funcionamento de uma pilha provém de reações químicas espontâneas que permitem obter um fluxo de elétrons que percorre um circuito externo.
4 Au(s) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 NaAu(CN)2(aq) + 4 NaOH(aq)
Com relação à reação acima, podemos afirmar que:
1. O NOX do Au varia de zero para +1; assim, o ouro sofre oxidação e, portanto, é o agente redutor.
2. É uma reação redox, mas não há variação no número de oxidação do sódio.
3. Cada mol de O2 recebe 4 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
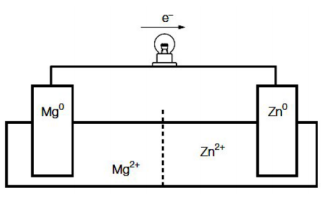
Sabendo-se que os elétrons fluem do eletrodo de magnésio para o eletrodo de zinco, é correto afirmar que