Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 659 questões
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Utilizando-se medidas potenciométricas, a determinação de
chumbo requer, necessariamente, o uso de padrões com
concentrações conhecidas para construção de uma curva
analítica.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Pode-se realizar a determinação de chumbo nas amostras por
meio de um sistema eletroquímico composto por um eletrodo
de referência prata-cloreto de prata e um eletrodo indicador de
primeira classe constituído de uma placa de chumbo.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Quando são realizadas medidas com o eletrodo de vidro de
soluções muito ácidas, podem ser observados valores de pH
menores que os reais, que são conhecidos como erros ácidos.
Sua principal origem consiste na saturação da membrana de
vidro por íons H+
.
A produção comercial do ácido nítrico envolve as seguintes reações químicas:
I. 4NH3(g) + 5O2(g ) → 4NO(g) + 6H2O(g)
II. 2NO(g) + O2(g) → 2NO2(g)
III. 3NO2(g) + H2O(L) → 2HNO3(aq) + NO(g)
É correto afirmar que são reações de oxirredução as descritas em:
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.
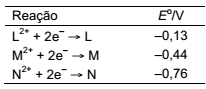
As pilhas eletroquímicas são dispositivos que produzem energia elétrica a partir de reações espontâneas de oxirredução que é medida pelo potencial de redução. De acordo com os potenciais de redução na tabela a seguir, assinale a afirmação CORRETA nas condições normais?
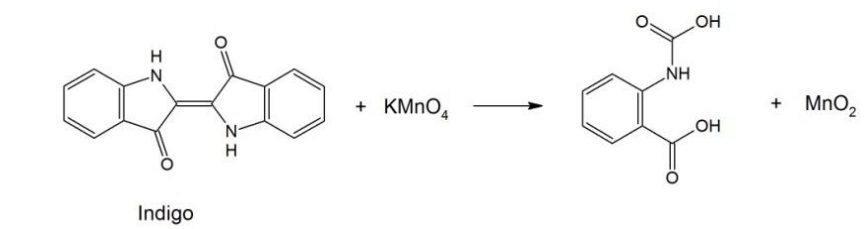
O jeans com aspecto “desbotado” pode ser obtido pela oxidação parcial do índigo impregnado no tecido (denim), utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
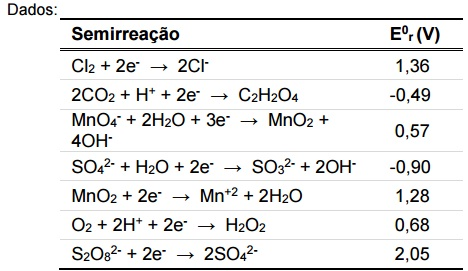
De acordo com os potenciais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncias que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
.
I. A forma de corrosão denominada uniforme se processa em toda a extensão da superfície, ocorrendo perda uniforme da espessura. II. Todos os metais estão sujeitos ao ataque corrosivo se o meio for sufcientemente agressivo. III. Os metais ouro e prata não sofrem nenhum tipo de corrosão. Está correto o que se afirma em:
 MnO2.H2O + (NH4)2SO4
Nessa reação química, o
MnO2.H2O + (NH4)2SO4
Nessa reação química, o I . Sempre envolve processos de óxido-redução. II . Cátodo é o eletrodo em que ocorre a redução. III . Polo negativo é aquele que libera elétrons para o circuito externo.
Está(ão) CORRETA(S) a(s) afirmativa(s):
2Fe(s) + O2(g) + 2H2O → 2Fe(OH)2(s)
Com base nas informações acima, é possível afirmar que: