Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)
Em seus compostos, o enxofre apresenta números de oxidação +6, +4, +2 e –2. São várias as espécies em solução ácida e básica. Nas espécies protonadas, os átomos de H estão ligados aos átomos de oxigênio dos oxiânicos. As espécies sulfuradas possuem diferentes potenciais padrão. Há de se notar que os oxiânicos de enxofre são agentes oxidantes muito mais fracos do que os de nitrogênio. Ainda sobre espécies de enxofre, analise as afirmativas a seguir.
I. Espécies no estado +6, no estado +4 e no estado +2 podem atuar apenas como agentes oxidantes, e nunca como agentes redutores, em reações redox.
II. Espécies no estado 0 (zero) podem atuar como agentes oxidantes ou como agentes redutores.
III. Espécies no estado –2 podem atuar apenas como agentes redutores, e nunca como agentes oxidantes, em reações redox.
Estão corretas as afirmativas
I. os eletrodos estejam conectados externamente, através de um condutor metálico. II. as duas soluções de eletrólitos estejam em contato, permitindo o movimento de íons entre elas. III. uma reação de transferência de elétrons possa ocorrer em cada um dos eletrodos.
São CORRETAS as afirmativas:
O rompimento de uma adutora de 700 mm de diâmetro na tarde de quinta-feira do dia 22 de março de 2018, localizada no quilômetro 59 da via marginal da Anhanguera, afetou o abastecimento de água em alguns bairros de Jundiaí (SP).
(Adaptado de: https://g1.globo.com)
Esse evento pode ocorrer devido à corrosão eletroquímica. Em tubulações de ferro é adequado fazer proteção catódica, utilizando ânodos fixados na tubulação que fica submersa no solo.
Considere os seguintes potenciais de redução, a 25,0 °C:
Fe2+(aq) + 2 e− ⇋ Fe(s) Eo = −0,440 V
Cu2+ (aq) + 2 e− ⇋ Cu(s) Eo = +0,337 V
Sn2+ (aq) + 2 e− ⇋ Sn(s) Eo = −0,136 V
Ni2+ (aq) + 2 e− ⇋ Ni(s) Eo = −0,250 V
Co2+ (aq) + 2 e− ⇋ Co(s) Eo = −0,277 V
Zn2+ (aq) + 2 e− ⇋ Zn(s) Eo = −0,763 V
O metal mais apropriado como ânodo é o
Oxirredução é um processo em que ocorre transferência de elétrons entre as espécies no decorrer de uma reação química.
K2Cr2O7 (aq) + 4 H2SO4 (aq) + 3 C2H5OH (aq) → 3 C2H4O (g) + K2SO4 (aq) + Cr2 (SO4)3 (aq) + 7 H2O (l)
Considerando a reação entre dicromato de potássio (K2Cr2O7) com álcool etílico (C2H5OH) na presença de ácido sulfúrico
(H2SO4),
Considere os seguintes potenciais de redução, a 25,0 °C:
Cu2+(aq) + 2 e− ⇋ Cu (s) Eo = +0,337 V
Ag+(aq) + e− ⇋ Ag (s) Eo = +0,799 V
Quando um fio de cobre (Cu) é imerso numa solução aquosa de nitrato de prata (AgNO3), ocorre uma reação de óxido redução devido a
Nessa medição, há eletrodo de
A reação de oxirredução que ocorre numa pilha de lítio é representada simplificadamente a seguir:
2 Li(s) + I2(s) → 2 Li+ (aq) + 2 I- (aq)
Dados os potenciais padrões de redução:
• Eº Li+ /Li = -3,05 V
• Eº I2 /I- = +0,53 V
verifica-se que a diferença de potencial padrão dessa pilha,
em volts, é
AgNO3(aq) + NaBH4 (aq) → Ag (s) + 1/ 2 H2 (g) + 1/ 2 B2H6 (g) + NaNO3 (aq)
Considerando-se a direção da formação dos produtos , na reação de oxirredução, a(o)
A reação a seguir é muito útil em procedimentos para determinação do teor de ferro.
SnCℓ2 (aq) + 2 FeCℓ3 (aq) → SnCℓ4 (aq) + 2 FeCℓ2 (aq)
Sobre essa reação, na direção da formação dos produtos, tem-se que
Dado
Eº (Fe3+/Fe2+) = +0,77 V
Eº (Sn4+/Sn2+) = +0,15 V
Dados: Massa atômica (g/mol): Cu = 63,5
Constante de Faraday = 96500 C/mol (Coulombs por mol de elétrons)
Reação no cátodo: Cu2+ (aq) + 2 e− → Cu(s)
Um anodo e um catodo são inseridos em uma solução eletrolítica. Sabe-se que o potencial de equilíbrio do catodo é 1,5 vezes o potencial de equilíbrio do anodo.
Observando que a força eletromotriz entre os eletrodos é V0, o potencial de equilíbrio do catodo, em função de V0, é
Uma amostra de minério (20,00 g) foi previamente solubilizada com uma mistura de ácidos inorgânicos e posteriormente diluída com água para ajustar seu volume para 1,00 L. Dessa solução, separam-se 250,00 mL que foram colocados em uma célula de um sistema eletrogravimétrico. Após a aplicação de um potencial adequado, o cobre da solução foi depositado, seletivamente, na superfície de um eletrodo de platina (em forma de rede para se ter elevada área superficial).
Se a massa de cobre depositada no eletrodo foi igual a 1,55 g, a percentagem (m/m) no minério é
O enxofre do H2S dissolvido em água pode ser precipitado por um processo eletrolítico, como indicado na equação a seguir.
H2 S(aq) + I2(aq) → S(s) + 2H+ (aq) + 2I- (aq)
Considere os seguintes potenciais normais de redução, de três metais genéricos X, Y e Z, respectivamente:
X2+ + 2 e- → X° E° = - 0 ,7 5 V
Y2+ + 2 e- → Y° E° = + 0 ,3 5 V
Z+ + e- → Z° E° = + 0 ,8 0 V
Assinale a alternativa que apresenta o melhor agente oxidante.
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
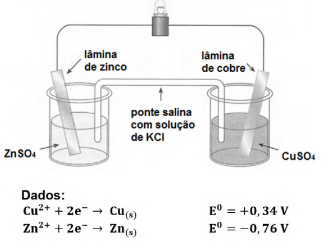
Acerca da situação apresentada, assinale a alternativa INCORRETA.