Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 676 questões
Em um experimento de laboratório, uma aluna foi solicitada a ordenar 3 elementos (A, B, C) de acordo com seus potenciais de redução. Para isso, realizou o seguinte procedimento: adicionou um pedaço de metal (A, B, C) em soluções aquosas contendo os cátions dos outros metais (A+, B2+, C2+) e também em solução ácida e observou onde ocorreu reação. Ao fim do experimento, elaborou uma tabela onde indicou com X os sistemas onde ocorreram reação com deposição de metal ou desprendimento de H2 , tendo obtido a seguinte tabela:
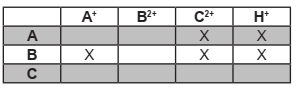
Ao organizar as espécies iônicas por ordem crescente de potencial de redução, com base no procedimento adotado e nos resultados tabelados, têm-se:
Corrosão eletroquímica de um metal é um processo que envolve reações redox espontâneas, como exemplo, a indesejada ferrugem. Esta é originada do processo corrosivo do ferro. Um procedimento para evitar a corrosão é a adição de um metal de sacrifício para ser ______________ preferencialmente por apresentar um ___________ potencial de ____________.
Assinale a alternativa que completa o texto acima corretamente.
Uma pilha foi montada com eletrodos de Al e Fe. Considerando as semirreações e os potenciais de redução apresentados a seguir, o valor do potencial da pilha mencionada, em Volts (V), é igual a
Dados:
Al3+ + 3e- ⇌ Al E0 = -1,66 V
Fe2+ + 2e- ⇌ Fe E0 = -0,44 V
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A eletricidade pode ser usada para fazer com que ocorram reações de oxirredução não espontâneas; na eletrólise, uma reação é levada à direção não espontânea pela passagem de uma corrente elétrica através da solução.
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
Em uma pilha galvânica, uma reação química é realizada, utilizando‐se corrente elétrica para sua ocorrência, de forma que a voltagem necessária é a subtração entre os potenciais de redução dos reagentes envolvidos.
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A produção de metais a partir de seus minérios é um processo eletroquímico constituído por reações de oxirredução, sendo esse evento um processo espontâneo realizado em indústrias siderúrgicas.
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A substância capaz de promover a redução de outra substância é denominada de agente redutor, enquanto a substância responsável pela oxidação de outra substância é denominada de agente oxidante.
A bateria de carro é um gerador de energiarelativamente barato, tem uma vida útil longa e umarecarga fácil. As semirreações dos eletrodos queconstituem as seis células da bateria convencionalnão selada, são:
Pb(s) + H2SO4(aq) →
PbSO4(s) + 2 H + + 2e- e0 = 0,36 Volts
PbO2(s) + H2SO4(aq) + 2e- + 2H+ →
PbSO4(s) + 2 H2O(l) e0 = 1,69 Volts
Considerando o enunciado acima, é correto afirmar
que
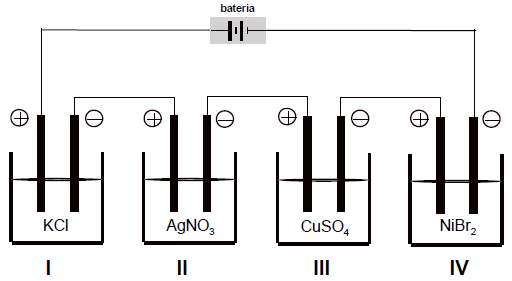
Sabendo-se que os eletrodos são inertes em todas as cubas, é correto afirmar que em
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
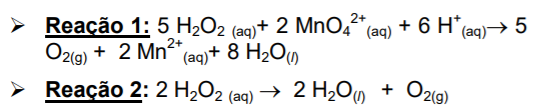
Com relação às informações dadas, podemos afirmar que:
I. A determinação de peróxido é um método complexiométrico. II. A expressão da concentração, em volumes decorre da auto protólise do peróxido. III. Na reação de permanganometria, o peróxido de hidrogênio é o agente redutor. IV. Para este procedimento deve ser empregado um indicador metalocrômico. V. A expressão “volumes de água oxigenada” se deve à geração de oxigênio na sua decomposição.
Estão CORRETAS apenas as afirmativas: