Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
As reações de oxidação e redução envolvem a
transferência de elétrons de uma espécie molecular ou
iônica para outra. A redução é a perda de elétrons por
uma dada espécie e a oxidação é a fixação desses
elétrons por uma determinada espécie.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
Eletroquímica é a parte da química que trata do uso das
reações químicas para produzir eletricidade, das
capacidades relativas de oxidação e redução e do uso da
eletricidade para produzir uma transformação química.
Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0 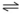 Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+ 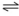 Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
As soluções de íons cério (IV) e de íons permanganato são reagentes oxidantes fortes muito utilizados na titulação de amostras que contenham ferro. A tabela a seguir mostra as semirreações e os correspondentes potenciais padrão de eletrodo.

A partir das informações precedentes, assinale a opção correta a
respeito de eletroquímica e dos assuntos suscitados por esse tema.
O agente oxidante em uma reação de oxidorredução é o elemento que perde elétrons, ou seja, sofre oxidação.
O agente oxidante em uma reação de oxidorredução é a substância que age causando a redução de um elemento pertencente a uma substância reagente.
Uma reação é considerada oxidorredução quando um ou mais elementos sofrem variações dos seus números de oxidação.
A oxidação e a redução não ocorrem simultaneamente, sendo necessário o término de uma para o início da outra.
O número de oxidação é o número que mede a carga real (ligação iônica) ou a carga parcial (ligação covalente) de uma espécie química.
A redução é a perda de elétrons por uma espécie química, enquanto a oxidação é o ganho de elétrons por uma espécie química.
X (s) / X2+ (1,05 mol/L) // Y2+ (1,10 mol/L) / Y (s)
Sobre a notação descrita, foram feitas as seguintes afirmações. I. As duas barras (//) indicam a ponte salina. II. X representa o eletrodo do anodo e Y, o eletrodo do catodo para reações espontâneas. III. O potencial da pilha se encontra em condição diferente do padrão.
Estão corretas as afirmações:
Considere a Tabela de potencial padrão de redução para algumas semicelas abaixo para responder a questão.

A força eletromotriz de uma pilha galvânica formada por duas semicelas nos estados padrões e conectadas por uma ponte salina pode ser estimada a partir da tabela de potenciais de redução.
O módulo da força eletromotriz para uma pilha de Cu e Zn, em V, é
Considere a Tabela de potencial padrão de redução para algumas semicelas abaixo para responder a questão.

Considere a Tabela de potencial padrão de redução para algumas semicelas abaixo para responder a questão.

Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A eletricidade pode ser usada para fazer com que ocorram reações de oxirredução não espontâneas; na eletrólise, uma reação é levada à direção não espontânea pela passagem de uma corrente elétrica através da solução.
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
Em uma pilha galvânica, uma reação química é realizada, utilizando‐se corrente elétrica para sua ocorrência, de forma que a voltagem necessária é a subtração entre os potenciais de redução dos reagentes envolvidos.


