Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
No laboratório, há uma solução de peróxido de hidrogênio 35,0% (v/v) em água.
Sabendo-se que, nas práticas de titulação de oxirredução, utiliza-se uma solução de
peróxido de hidrogênio 8,4% (v/v) em água, qual é o volume de solução de peróxido de
hidrogênio 35,0% (v/v) necessário para preparar 250 mL de solução de peróxido de
hidrogênio 8,4% (v/v)?
A figura seguinte representa o processo de eletrólise empregado na purificação de cobre, no qual por uma solução de sulfato de cobre (CuSO4) passa uma corrente elétrica que promove uma deposição de 8,50 g de cobre no cátodo.
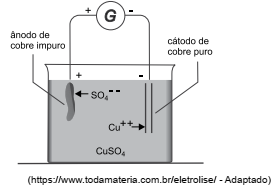
Dados: massas molares Cu=64g; O=16g; S=32g.
Nesse experimento, com base na massa de deposição
de Cobre no cátodo, a massa, em gramas, de sulfato de
cobre (CuSO4) decomposta foi de
Zn (s) → Zn2+ (aq) + 2e- Eº = +0,76 V
Inicialmente, na semicélula 1, a concentração da solução de íons zinco era igual a 1,5 mol/L e, na semicélula 2, a concentração de íon zinco era igual a 0,5 mol/L.
Dado: log3 = 0,5
Com base nessas informações, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) No eletrodo da semicélula 2, encontra-se o catodo da pilha. ( ) No eletrodo da semicélula 1, encontra-se o polo negativo. ( ) A força eletromotriz da pilha é aproximadamente 0,75 V. ( ) Possivelmente, a pilha não funcionará, porque os eletrodos são um único elemento.
Assinale a sequência correta.
Ca(OH)2 + HCI → CaCl2 + H2O
Com base nessa reação química, é correto afirmar que
A potenciometria se baseia na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente.
Aponte, entre os termos abaixo, o único que não está relacionado ao estudo dos métodos potenciométricos.
Um técnico possui quatro tipos de placas de metal (de cobre, de zinco, de chumbo e de prata) e soluções aquosas de sulfato de cobre, de sulfato de zinco, de nitrato de chumbo e de nitrato de prata.
Uma reação química redox espontânea ocorre quando a
placa de 
Assinale a alternativa correta
Considere as seguintes semi-reações e assinale a alternativa com a afirmação correta.

Dada a equação abaixo:
SnCl2 + 2 HCl + H2O2 → SnCl4 + 2 H2O.
Analise as afirmações feitas acerca do processo de oxidoredução que ocorre nessa reação:
I. O estanho sofre redução.
II. O peróxido de hidrogênio é o agente oxidante.
III. O ácido clorídrico é o agente redutor.
IV. A variação do nox do estanho é de +2 para +4.
Estão corretas as afirmativas:
Ni(s) → Ni2+(aq) + 2e- E°oxi = + 0,236 V Ag(s) → Ag+(aq) + e- E°oxi = - 0,799 V
A partir destes dados, assinale a alternativa que corresponde ao potencial-padrão da célula.
Pb2+(aq) + 2e- → Pb(s) E°red = - 0,127 V Zn2+(aq) + 2e- → Zn(s) E°red = - 0,762 V Cu2+(aq) + 2e- → Cu(s) E°red = + 0,339 V Mn2+(aq) + 2e- → Mn(s) E°red = - 1,182 V Fe2+(aq) + 2e- → Fe(s) E°red = - 0,409 V
A partir desses dados, assinale a alternativa em que o elemento químico é considerado o melhor agente redutor em reações redox espontâneas.
Considere as informações a seguir para responder à questão.
Na verificação qualitativa de íons iodato, IO-3 , foi realizado o teste com íons iodeto em meio ácido, segundo a equação não balanceada:
IO-3 (aq) + I-(aq) + H+(aq) → I2(s) + H2O(ℓ)
Para identificar a formação do I2 (s), toma-se uma alíquota da amostra após a reação, adiciona-se clorofórmio e agita-se. Ao final, se o iodo estiver presente, é observada coloração violeta rosada na fase orgânica.
Após uma aula experimental, o técnico de laboratório armazenou uma solução 0,015 mol L-1 de KMnO4 num recipiente de prata. Nesse contexto, considere os dados abaixo.
Dados:
E°(Ag+ /Ag0 )= 0,880 V e E°(MnO4- /Mn2+) = 1,510 V
∆G° = -n F ∆E° (sendo n o número de elétrons e F a constante de Faraday - 96450 C mol-1 )
Com base nesses dados e de acordo com os valores dos potenciais padrão de redução para
as duas semi-reações da célula eletroquímica, o recipiente de prata é