Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Em um laboratório didático, para ensinar a tabela de potencial-padrão de redução (E0), foi construída uma pilha usando limão como eletrólito, conforme a figura.

Fonte: www.preparaenem.com/quimica/pilha-limao.htm
O laboratório dispunha dos metais apresentados no quadro a seguir.

Foi escolhido um fio de zinco como ânodo. Para que
a cela seja espontânea, como cátodo pode(m) ser
escolhido(s)
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
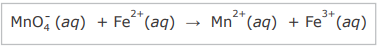
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
Corrente Elétrica 10 A
Tempo 30 min
Pressão 1,0 atm
Temperatura 273 K
Sabendo que, nessas condições, foram recolhidos 1,7 L de gás hidrogênio é possível prever que o rendimento do processo foi, aproximadamente, de
(Dado: Constante de Faraday = 96.500 s.A.mol-1)
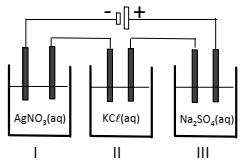
Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Na reação apresentada, o número de oxidação do ferro
passou de +3 para 0.

Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1, 2 ou 3) representa a variação de entalpia da n-ésima etapa:

A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
Atenção: Para responder à questão, considere as informações abaixo.
As baleias são os maiores seres vivos do planeta e importantes recicladores de nutrientes dos oceanos. Elas consomem uma quantidade colossal de alimento e suas fezes fertilizam as águas próximas à superfície. Por exemplo, uma baleia azul come cerca de 16 toneladas de peixes, lulas e pequenos crustáceos por dia. Hoje, apenas no oceano Austral, as baleias reciclam por ano, 1 200 toneladas de ferro, nutriente essencial para a reprodução do plâncton, organismos microscópicos que estão na base da cadeia alimentar marinha e contribuem para captar gás carbônico da atmosfera.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
Considerando que o ferro reciclado pelas baleias no oceano Austral anualmente esteja na forma de íons Fe3+ , a massa de íons cloreto necessária para neutralizar toda sua carga elétrica é, em toneladas, de, aproximadamente:
Dados:
Massas molares (g/mol)
Cℓ = 35,5;
Fe = 55,8
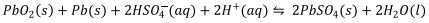
Dados: E° red (cátodo) = + 1,685 V e E° red (ânodo) = - 0,356 V
Analise as afirmações numeradas de I a IV em relação a esse tipo de bateria.
I. Os eletrodos de PbO2(s) e Pb(s) são inertes, sendo o potencial de pilha dependente apenas da concentração de ácido sulfúrico.
II. No processo de recarga da bateria ocorre redução do pH do meio aquoso.
III. O Pb(s) atua como agente redutor no processo de recarga da bateria.
IV. O processo de descarga leva a um potencial padrão de pilha de +2,041 V e a uma redução da densidade do eletrólito.
Assinale a alternativa CORRETA.
Mn2+ (aq) + H2 O(l) → MnO2(s) + 4 H+ (aq) + 2e
Com base no experimento apresentado e no seu resultado, uma conclusão correta sobre o eletrodo onde se depositou o MnO e sobre o valor percentual mais próximo de Mn na amostra é que o eletrodo foi o
Dado: MMnO = 71 g mol-1 MMn = 55 g mol-1
São características do sistema galvânico e do sistema corrente impressa, respectivamente:
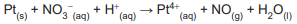
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
Dados: MMCu = 63,5 g mol-1 / Constante de Faraday = 96500 C
Nessas condições, o valor da energia livre de Gibbs padrão da reação, em kJ mol-1, é mais próximo de
Dado
Constante de Faraday (F) = 96500 C mol-1
Nessas condições, a diferença de potencial (
 E) medida,
em volts, é
E) medida,
em volts, é Dado
Potências de redução versus eletrodo padrão de hidrogênio:
Fe3+(aq) + e → Fe2+(aq) Eo = +0,77 V
Sn4+(aq) + 2e → Sn2+(aq) Eo = +0,15 V
Equação de Nernst:
E = Eo redução – 0,06 log([produtos]n/[reagentes]m)
NO-3 + 8 Cℓ- + 10H+ → 4 Cℓ2 + NH+4 + 3 H2O
Nessa reação, a espécie química que sofre oxidação é
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
Considera-se que o potencial produzido por uma célula
galvânica seja a soma das contribuições do anodo e do
catodo, ainda que o potencial de junção líquida seja
considerável.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
A equação de Gibbs, ΔG = ΔGº + RT lnQ, traduz a
dependência da tensão imposta a células eletroquímicas em
relação às concentrações das espécies envolvidas.