Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Considere: Fe2+ (aq) + 2 e- → Fe(s) E° red = -0,44 V
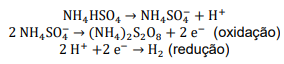
A hidrólise do persulfato de amônio forma H2O2:
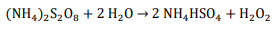
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
Através da corrente elétrica gerada no dispositivo é calculada a massa de álcool exalada pela pessoa. A seguir, para obter o teor de álcool no sangue do indivíduo é utilizada a correlação:
Concentração de álcool no sangue, em g/mL = 2000 x (Concentração de álcool no sopro, em g/mL). Se em um teste é realizado um sopro de 50 mL, registrando-se uma corrente de 0,2 A (ampéres) durante 30 segundos, qual o teor de álcool no sangue dessa pessoa?
Assinale a opção CORRETA: Dados eventualmente necessários: Massa molar do etanol = 46 g/mol; 1 A = 1 Coulomb/s; Constante de Faraday, F = 96500 C/(mol de e- ).
O alumínio é comumente encontrado na natureza formando minerais, como a criolita (Na3AℓF6). Esse mineral apresenta brilho vítreo e sua cor varia de incolor a branco.
Um processo industrial que utiliza a eletrólise ígnea da criolita, usa uma carga de 1 x 106 Faradays.
Nesse processo, a quantidade de alumínio metálico produzido corresponde, aproximadamente, a
Dados: 1F = 96500C, Massa molar Aℓ = 27 g.mol–1
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
Dados: E0(Zn2+/ Zn) = – 0,76V E0(Cu2+/ Cu) = + 0,34V
Nessa pilha, formada por zinco e cobre, temos
I. 2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
A0│A+n ║ B+n│B0
em que A0 e B0 são as espécies A e B reduzidas, A+n e B+n são as espécies A e B oxidadas, o símbolo │ corresponde à interface metal/solução, e a representação ║ é a ponte salina.
Considerando que pilhas com celas separadas necessitam de uma ponte salina para funcionar, a função dessa ponte salina no conjunto é de:
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Em uma soldagem com eletrodo revestido, o elevado ponto
de fusão do tungstênio permite a aplicação desse metal como
eletrodo não consumível.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
O tipo de corrosão mais comum nas tubulações e
equipamentos industriais é a eletroquímica, na qual um
componente oxida, ou seja, ganha elétrons, e o outro reduz,
ou seja, perde elétrons.
No que se refere a reações de óxido-redução, julgue o próximo item.
Nas reações de óxido-redução, os elétrons perdidos pela
espécie que sofre redução serão recebidos pela espécie que
se oxida.
Um valor de força eletromotriz positiva está associado a um processo redox espontâneo.
Se uma barra de cobre for colocada dentro de uma solução de H2SO4 em condições padrão, então, considerando-se os potenciais padrão de redução do cobre (Cu2+/Cu, 0,337 V) e do hidrogênio (H+/H2, 0,000 V), a barra de cobre reagirá, e a solução se tornará azul pela presença de Cu2+.
A força eletromotriz é associada à espontaneidade da reação por meio da entalpia.
Em função do potencial de redução de cada semirreação, a força eletromotriz é calculada subtraindo-se o potencial de redução da semirreação de oxidação do potencial de redução da semirreação de redução.