Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

I. As medidas potenciométricas apresentam alta sensibilidade, tempo de resposta curto, facilidade de escalonamento e automação; elas funcionam bem com solventes orgânicos; cor e turbidez não são interferentes. II. O método potenciométrico se baseia na medida do potencial de células eletroquímicas, com o consumo apreciável de corrente. III. O eletrodo indicador apresenta corrente que varia de forma conhecida com alterações na concentração do analito. IV. O eletrodo de referência é uma meia-célula que tem um potencial de eletrodo conhecido, que permanece constante sob temperatura constante, independente da composição da solução do analito.
Está correto o que se afirma apenas em
Assinale a alternativa que indique corretamente o método descrito acima.
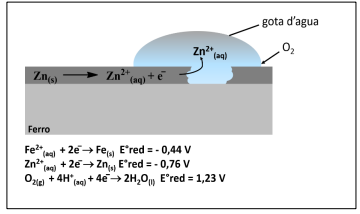
( ) Na oxidação do ferro exposto ao tempo, no anodo ocorre a reação Fe → Fe2+ + 2e − e no catodo ocorre a reação O2 +4H + + 4e − → 2H2O.
( ) Uma forma de proteger a oxidação do ferro e fazer uma proteção catódica, é usar um metal de sacrifício como o magnésio. Isso ocorre pois o ferro possui um potencial de redução mais negativo que o magnésio.
( ) A proteção de superfícies metálicas da corrosão independe do meios corrosivos existentes, sendo o meio corrosivo, um fator secundário da corrosão.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
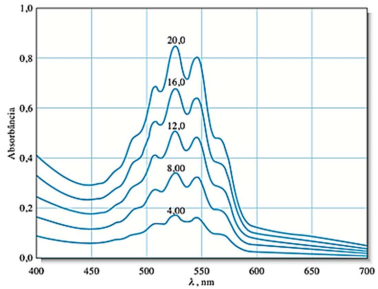
Assinale com V (verdadeiro) ou F (falso) as afirmações a seguir.
( ) Na condição ideal de análise, observa-se que a lei de Beer é aproximadamente obedecida.
( ) Sabendo-se que a solução tem cor violeta, ela absorve majoritariamente radiação de frequência correspondente a essa cor.
( ) Para uma determinação otimizada da concentração de íons permanganato utilizando essa técnica, deve-se utilizar uma radiação de comprimento de onda de 525 nm.
( ) Para uma determinação otimizada da concentração de íons permanganato utilizando essa técnica, deve-se utilizar uma radiação de frequência igual a 525 nm.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Cd2+ + 2e ⇌ Cd (s) E° = - 0,40 V
Ni2+ + 2e ⇌ Ni (s) E° = - 0,25 V
É correto afirmar
Tabela Concentração limite das substâncias que causam interferência na determinação do íon fluoreto.
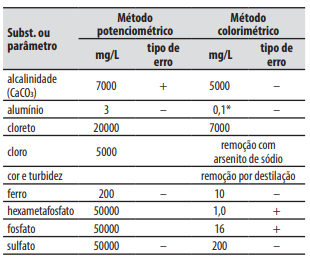
Assinale a alternativa correta a respeito do que foi apresentado.
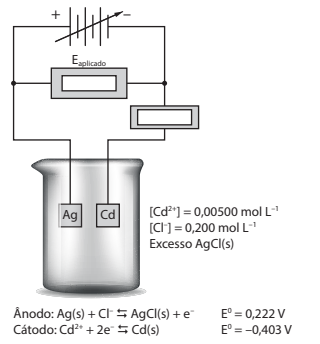
https://www.inesul.edu.br/site/documentos/ QUIMICA_ANALITICA_SKOOG.pdf
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
Em uma aula de eletroquímica, o professor construiu uma pilha usando os metais níquel e ferro e soluções 1,0 mol/L de sais de seus cátions. A figura representa um esquema da pilha.
São dados os potenciais padrão de redução dos metais.
Ni2+ (aq) + 2e- → Ni(s) E0 = - 0,25 V
Fe2+ (aq) + 2e- → Fe(s) E0 = - 0,44 V
Em relação a essa pilha, é correto afirmar que durante seu funcionamento a 25oC forma-se
A concentração de alumínio em uma estação de tratamento de água (ETA) é maior na etapa de decantação, podendo ser medida por análise gravimétrica, por precipitação, como uma base, com posterior calcinação a óxido de alumínio,cuja massa pode ser determinada.
Uma alíquota, sob análise em uma ETA, seguindo o processo gravimétrico, produziu 0,625 g de precipitado calcinado. Por essa análise, o teor de alumínio encontrado, em gramas, na etapa analisada é igual a:
(Dados, em g/mol: Al=27 e 0=16)
O silício elementar pode ser obtido em escala laboratorial por redução com metais básicos, a partir do dióxido de silício ou tetrafluoreto de silício, conforme os exemplos a seguir.
SiO2 + 2 Mg → Si + 2 MgO
3SiO2 + 4 Al → 3Si + 2Al2O3
3SiF4 + 4Al → 3Si + 4 AlF3
Em relação às substâncias apresentadas, assinale a alternativa correta.
Pilha é um dispositivo eletroquímico que aproveita a espontaneidade de uma reação de oxirredução para produzir trabalho. Esse trabalho, diferentemente de uma expansão gasosa, é realizado dentro de um circuito elétrico. A célula eletroquímica característica de reações espontâneas é a
Um experimento bastante utilizado por professores e alunos nas aulas de eletroquímica consiste em realizar a eletrólise de uma solução aquosa salina com uma pequena quantidade de azul de bromotimol. O azul de bromotimol atua como um indicador ácido-base da solução, conferindo a ela a coloração amarela em meio ácido, verde em meio neutro, e azul em meio básico (alcalino). Considere a eletrólise de uma solução aquosa de sulfato de sódio, contendo azul de bromotimol em concentração suficiente para visualização das três cores citadas, em uma cuba eletrolítica adequada e equipada com eletrodos metálicos inertes.
Indique a alternativa que apresenta, correta e respectivamente, as colorações que serão observadas na solução antes do início da eletrólise e durante a eletrólise ao redor do ânodo e do cátodo.
Dados: Semirreações de redução e respectivos potenciais padrão.
Na+ (aq) + 1 e─ → Na (s) |
E 0 = - 2,71 V |
2 H+ (aq) + 2 e─ → H2 (g) |
E0 = 0,00 V |
2 H2O (l) + O2 (g) + 4 e─ → 4 OH─ (aq) |
E0 = + 0,40 V |
S2O82─ (aq) + 2 e─ → 2 SO42─ (aq) |
E0 = + 2,05 V |
Assinale a alternativa que preenche corretamente as lacunas.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A solução de sal light é classificada como eletrolítica e a sua
condutibilidade elétrica é tão maior quanto menor for a sua
concentração.
O quadro abaixo apresenta potenciais-padrão (E0) para semirreações de redução de cinco elementos.
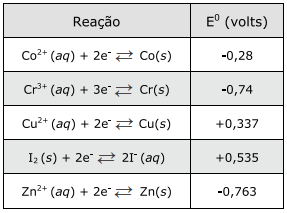
A ordem crescente de poder redutor conforme as
reações de redução acima é
