Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
O potencial arbitrariamente atribuído ao eletrodo-padrão de
hidrogênio, na faixa de temperatura de 20 ℃ até 30 ℃, é
0 V.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Considere as equações químicas a seguir.
I NH3 + H2O ⇌ NH4+ + OH−
II Cu2+ + 4 NH3 ⇌ [Cu(NH3)4] 2+
III 2 Fe3+ + Sn2+ ⇌ 2 Fe2+ + Sn4+
Ocorre reação de oxirredução apenas na(s) equação(ões)
No que se refere aos processos de corrosão, julgue o item a seguir.
Zinco e magnésio são frequentemente utilizados como
anodos de sacrifício em métodos de proteção galvânica em
ferro, por possuírem maior potencial eletroquímico.
No que se refere aos processos de corrosão, julgue o item a seguir.
A corrosão galvânica consiste na remoção de elétrons do
catodo na presença de um material com potencial de eletrodo
maior.
A corrosão de metais pode ser definida como o ataque eletroquímico destrutivo e não intencional que geralmente se inicia na superfície. O problema da corrosão metálica é de grande proporção no âmbito econômico, sendo estimado aproximadamente 5% das receitas de uma nação industrializada sejam gastos na prevenção deste processo e na manutenção ou substituição de produtos perdidos ou contaminados, resultado de reações corrosivas.
(Fonte: CALLISTER, W; RETHWISCH, D. Ciência e Engenharia de Materiais Uma Introdução. 8 ed, Rio de Janeiro, LTC, 2012 Com adaptado).
Em relação à corrosão galvânica, existem várias medidas que podem ser adotadas para diminuir seus efeitos. Uma dessas medidas é:
Os principais meios corrosivos de materiais são os mecanismos químico e eletroquimico. No processo de corrosão eletroquímica, ocorre um fluxo de elétrons, que se desloca de uma área da superfície metálica para a outra. A diferença de potencial de natureza eletroquimica, se estabelece entre as regiões que envolvem transferência desses elétrons. As reações na corrosão eletroquimica são anódicas e catódicas (oxidação e redução). Assim, é correto afirmar que:
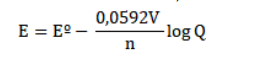
Zn+2(aq)/Zn(s)= - 0,763 V NO3 - /NO(g) = 0,96 V P NO(g) = 2,0 atm [H+ ] = 1,0 mol/L [Zn+2] = 1,0 mol/L [NO3 - ]= 1,0 mol/L
têm-se:
I - Realizarem-se, necessariamente, na presença de água líquida.
II - Realizarem-se em temperaturas, acima do ponto de orvalho.
III - Realizarem-se devido à formação de pilhas de corrosão ou células eletroquímicas.
Está correto o que se afirma em:
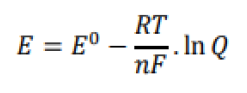
Considerando a equação, acima, E0 representa:
Assinale a alternativa que preenche, corretamente, a lacuna do texto:
I - Reação espontânea.
II - Dividida em Ígnea e Aquosa.
III - Precisa de energia elétrica para ocorrer.
Está correto o que se afirma em:
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.
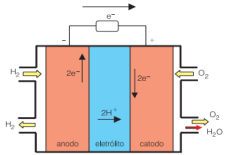
Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a,célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.
- O ar expelido pelos pulmões do suspeito é bombeado em uma solução de dicromato de potássio fortemente acidulada (ácido sulfúrico); - O etanol presente na boca do motorista (se este consumiu bebida alcoólica) reage com os íons dicromato da solução, produzindo acetaldeído e íons Cromo (III); - Em razão da reação química, ocorre uma mudança na cor da solução, a cor característica laranja passa para um tom esverdeado, acusando a presença de álcool etílico ou etanol.
Adaptado. Composição química do Bafômetro - Mundo Educação (uol.com.br). (Acesso em 23 de Julho de 2021)
A reação que ocorre no bafômetro com dicromato de potássio está representada pela equação química não balanceada a seguir:
K2Cr2O7(aq) + x H2SO4(aq) + 3CH3CH2OH(g) → alaranjado incolor
Cr2(SO4)3(aq) + y H2O(l) + 3CH3CHO(g) + K2SO4(aq) verde incolor
Assinale a alternativa que relaciona a classificação e os respectivos valores de x e y (mínimos coeficientes inteiros) que balanceiam corretamente a reação do bafômetro com dicromato de potássio.
A pilha de lítio, muito leve por conta da baixa densidade desse metal, foi utilizada inicialmente apenas em marca-passos cardíacos. As semirreações que ocorrem numa pilha de lítio podem ser descritas por:
A diferença de potencial gerada por essa pilha, em volts, é igual a:
Disponível em: <http://cfq.org.br/noticia/>. Acesso em: 3 mar. 2021, com adaptações.
Com base nessas informações, é correto afirmar que a eletrólise consiste em um processo
I. A eletrólise é um processo no qual o trabalho elétrico gera a reação química.
II. Se o cloreto de sódio for submetido a uma eletrólise ígnea ou aquosa, os produtos dessa reação são os mesmos: sódio metálico e gás cloro.
III. Na eletrólise em meio aquoso, quem irá definir a ordem de descarga dos íons é o potencial de redução padrão, E°red, de cada substância durante esse processo.
IV. A quantidade formada de produtos eletroquímicos será definida pela primeira lei de Faraday.
É CORRETO o que se afirma em