Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 659 questões
Ca(OH)2 + HCI → CaCl2 + H2O
Com base nessa reação química, é correto afirmar que
Na pilha de corrosão formada por materiais de natureza química diferente, também denominada corrosão galvânica, ocorre uma corrosão eletroquímica, em presença de um eletrólito, tão mais intensa quanto mais afastados na série galvânica estiverem os pares em contato.
A presença de gás carbônico e cloreto em concentrações elevadas favorece e acelera a corrosão.
A presença de ácidos diluídos na água favorece a ocorrência de corrosão.
Pode-se obter sódio metálico, a partir de NaCl por um processo de eletrólise.
(Dados: M.M em g.mol⁻¹ K = 39,1 O = 15,9 Cr = 52,0)
I - Em eletrodos de membrana, o potencial se deve a um potencial de junção entre a membrana que separa a solução do eletrodo e a solução que contém a espécie a ser analisada.
II - A membrana íon-seletiva deve ser praticamente insolúvel na solução da espécie a ser analisada.
III - As membranas podem ser de vidro, membranas trocadoras de íons e membranas sólidas cristalinas.
Está(ão) correta(s) a(s) afirmativa(s):
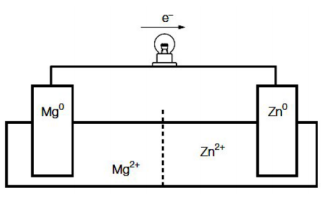
Sabendo-se que os elétrons fluem do eletrodo de magnésio para o eletrodo de zinco, é correto afirmar que
Dado os seguintes potenciais padrões:
Aℓ3+ + 3e- → Aℓ Eº = − 1,66V
Zn+2 + 2e- → Zn Eº = − 0,76V
Fe+2 + 2e- → Fe Eº = − 0,44V
Cu2+ + 2e- → Cu Eº = + 0,34V
Ag+ + 1e- → Ag Eº = + 0,80V
O melhor agente redutor é
Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0  Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+  Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
A quantidade de matéria orgânica em águas superficiais e residuais pode ser expressa por meio da demanda química de oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em águas pode ser representada como:
matéria orgânica + (Cr2O7 )2- + H+ ⇄ 2 Cr3+ + CO2 + H2O
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2 .
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formar CO2 .
Está correto o que se afirma em
O professor propôs, como introdução ao estudo das reações de oxirredução, um experimento bem simples para que o aluno tenha condições de observar um fenômeno que envolve mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de vitamina C não efervescente a uma solução de iodo (farmacêutica) e adicionar água. Nessa reação a vitamina C que é oxidada promove um descoramento da solução de iodo que é reduzido.
A transformação que ocorre no iodo pode ser codificada em uma linguagem química como
As soluções de íons cério (IV) e de íons permanganato são reagentes oxidantes fortes muito utilizados na titulação de amostras que contenham ferro. A tabela a seguir mostra as semirreações e os correspondentes potenciais padrão de eletrodo.

A partir das informações precedentes, assinale a opção correta a
respeito de eletroquímica e dos assuntos suscitados por esse tema.
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
O agente oxidante em uma reação de oxidorredução é o elemento que perde elétrons, ou seja, sofre oxidação.
