Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A produção de metais a partir de seus minérios é um processo eletroquímico constituído por reações de oxirredução, sendo esse evento um processo espontâneo realizado em indústrias siderúrgicas.
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A substância capaz de promover a redução de outra substância é denominada de agente redutor, enquanto a substância responsável pela oxidação de outra substância é denominada de agente oxidante.
A bateria de carro é um gerador de energiarelativamente barato, tem uma vida útil longa e umarecarga fácil. As semirreações dos eletrodos queconstituem as seis células da bateria convencionalnão selada, são:
Pb(s) + H2SO4(aq) →
PbSO4(s) + 2 H + + 2e- e0 = 0,36 Volts
PbO2(s) + H2SO4(aq) + 2e- + 2H+ →
PbSO4(s) + 2 H2O(l) e0 = 1,69 Volts
Considerando o enunciado acima, é correto afirmar
que
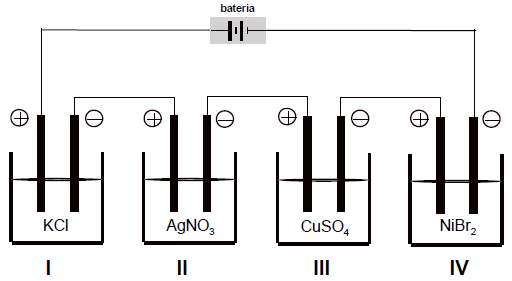
Sabendo-se que os eletrodos são inertes em todas as cubas, é correto afirmar que em
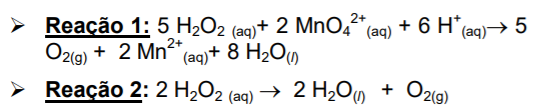
Com relação às informações dadas, podemos afirmar que:
I. A determinação de peróxido é um método complexiométrico. II. A expressão da concentração, em volumes decorre da auto protólise do peróxido. III. Na reação de permanganometria, o peróxido de hidrogênio é o agente redutor. IV. Para este procedimento deve ser empregado um indicador metalocrômico. V. A expressão “volumes de água oxigenada” se deve à geração de oxigênio na sua decomposição.
Estão CORRETAS apenas as afirmativas:
Fe+2(aq) + 2 e- → Fe(s) E° = - 0,44 V Pb+2(aq) + 2 e- → Pb(s) E°= - 0,13 V
E considerando a formação de uma pilha, são feitas as seguintes afirmativas:
I. A reação que ocorre no cátodo é Pb+2(aq) + 2 e- → Pb(s). II. A Pilha pode ser representada por Fe2+(aq) / Fe(s) // Pb2+(aq) / Pb(s). III. A voltagem da pilha é igual a 0,31 V. IV. A reação não é espontânea.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
A proteção catódica é um método utilizado para a proteção de estruturas. Com isso, tubulações e tanques de estocagem, entre outros, são protegidos por esse método. Em uma aula de química, deseja-se estudar a proteção da corrosão de um equipamento constituído basicamente por ferro, empregando-se o método da proteção catódica com o uso de um metal de sacrifício. Nesse contexto, a tabela a seguir mostra os potenciais-padrão de redução (E°) de algumas espécies.

1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)  2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 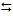 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
Sobre a reação a seguir é CORRETO afirmar:
AsF3(g) + SbF5(l) → [AsF2]+[SbF6]-
(s)
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)