Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Em um experimento sobre corrosão, foram preparados 5 tubos de ensaios com lâminas de aço imersas em diferentes soluções salinas, conforme mostrado na Tabela abaixo.
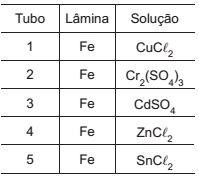
Com base nos potenciais de redução
Fe2+ + 2e ↔ Fe (E0 = - 0,44 V)
Cu2+ + 2e ↔ Cu (E0 = + 0,34 V)
Cr3+ + 3e ↔ Cr (E0 = - 0,74 V)
Cd2+ + 2e ↔ Cd (E0 = - 0,40 V)
Zn2+ + 2e ↔ Zn (E0 = - 0,76 V)
Sn2+ + 2e ↔ Sn (E0 = - 0,14 V)
pode-se concluir que serão observadas reações nos tubos
Em uma pilha Ni0 |Ni2+||Cu2+|Cu0 , os metais estão mergulhados em soluções aquosas 1,0 M de seus respectivos sais a 25ºC.
O valor da força eletromotriz (f.e.m) da pilha, em V, é

Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química:
A estimativa da constante de Avogadro pode ser realizada através da eletrólise da água. Em um experimento que foi realizado por estudantes secundaristas para essa finalidade obteve-se 6,1x1023 como valor para a constante. Na realização desse experimento, foram empregados fios de cobre de 2,5mm de diâmetro, duas seringas de injeção de 10,0mL, um pedaço de isopor para servir com suporte para as seringas, solução de hidróxido de sódio 10g/L, bateria de 6V e uma cuba de plástico. Através de um amperímetro, mediu-se a corrente que saiu da fonte cujo valor foi de 30mA. O experimento foi montado conforme a ilustração, Figura 1.
Considerando a pressão local igual a 663mmHg, R = 8,314 J/Kmol, a temperatura ambiente de 27ºC e o volume de Hidrogênio coletado de 5,5 mL, em quanto tempo, aproximadamente, ocorreu o experimento:
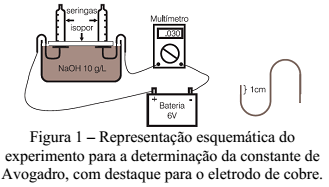
Experimento e figura extraída de:
Mól, Gerson de Souza; Ferreira, Geraldo A. Luzes; da Silva,
Roberto Ribeiro; Laranja, Hércules F. QNEsc e a Seção
Experimentação no Ensino de Química. Revista Química
Nova na Escola. São Paulo, v. 3, p. 32-33, 1996.
A corrosão eletroquímica é a de maior presença nos mais diversos ambientes, é para tal processo corrosivo que se prepara a superfície metálica de torres, com o objetivo de impedir a formação de pilhas ou células corrosivas. Os processos de corrosão, nesse caso, caracterizam-se por:
I. Acontecerem necessariamente sem a presença de água líquida.
II. Acontecerem em temperaturas abaixo do ponto de orvalho, sendo em maior parte na temperatura ambiente.
III. Acontecerem devido à formação de pilhas de corrosão ou células eletroquímicas.
Estão corretas as afirmativas.
Dados massas atômica (g mol-1): Fe = 56; O = 16.
A produção comercial do ácido nítrico envolve as seguintes reações químicas:
I. 4NH3(g) + 5O2(g ) → 4NO(g) + 6H2O(g)
II. 2NO(g) + O2(g) → 2NO2(g)
III. 3NO2(g) + H2O(L) → 2HNO3(aq) + NO(g)
É correto afirmar que são reações de oxirredução as descritas em:
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.
O jeans com aspecto “desbotado” pode ser obtido pela oxidação parcial do índigo impregnado no tecido (denim), utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
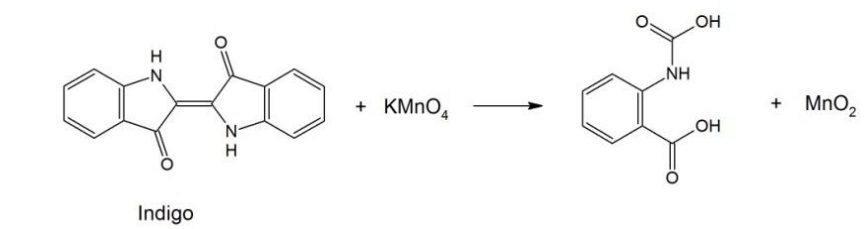
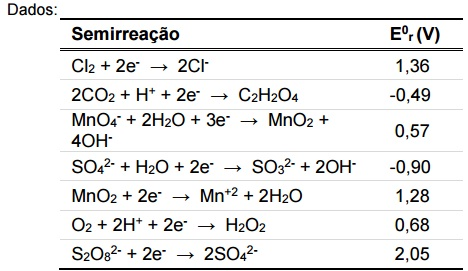
De acordo com os potenciais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncias que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
.
Qual a energia livre (ΔG) aproximada para a reação da célula eletroquímica descrita abaixo? Cu ǀ Cu2+ (0,0100 mol L-1 ) ‖ Ag+ (0,0100 mol L-1 ) ǀ Ag
Dados potenciais padrão:
Eo (Ag+ /Ag) = +0,799V
Eo (Cu2+/Cu) = +0,337V
Ni2+(aq) + 2e-
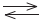 Ni(s) Eredo
= -0,28V
Ni(s) Eredo
= -0,28V A tensão teórica gerada por essa pilha é: