Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 670 questões
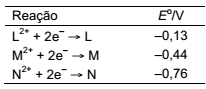
As pilhas eletroquímicas são dispositivos que produzem energia elétrica a partir de reações espontâneas de oxirredução que é medida pelo potencial de redução. De acordo com os potenciais de redução na tabela a seguir, assinale a afirmação CORRETA nas condições normais?
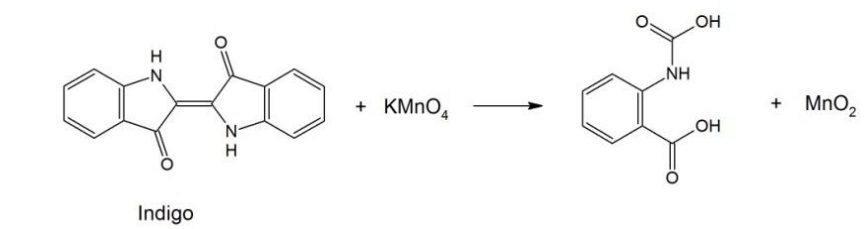
O jeans com aspecto “desbotado” pode ser obtido pela oxidação parcial do índigo impregnado no tecido (denim), utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
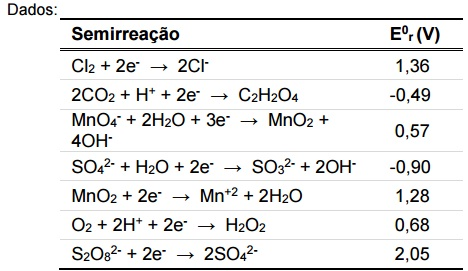
De acordo com os potenciais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncias que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
.
I. A forma de corrosão denominada uniforme se processa em toda a extensão da superfície, ocorrendo perda uniforme da espessura. II. Todos os metais estão sujeitos ao ataque corrosivo se o meio for sufcientemente agressivo. III. Os metais ouro e prata não sofrem nenhum tipo de corrosão. Está correto o que se afirma em:
 MnO2.H2O + (NH4)2SO4
Nessa reação química, o
MnO2.H2O + (NH4)2SO4
Nessa reação química, o I . Sempre envolve processos de óxido-redução. II . Cátodo é o eletrodo em que ocorre a redução. III . Polo negativo é aquele que libera elétrons para o circuito externo.
Está(ão) CORRETA(S) a(s) afirmativa(s):
2Fe(s) + O2(g) + 2H2O → 2Fe(OH)2(s)
Com base nas informações acima, é possível afirmar que:
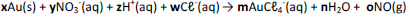
Onde x, y, z, w, m, n e o são coeficientes estequiométricos. Sobre essa reação assinale a alternativa CORRETA:
Qual o potencial da célula, em V, para o processo eletroquímico no qual o ferro pode reduzir os íons prata?

O texto a seguir foi adaptado de Quim. Nova, v. 39, 732- 740, 2016.
“Nos ambientes aquáticos, a concentração de fosfatos na coluna de água é dependente de alguns fatores, como o par redox Fe(II)/Fe(III), uma vez que nas camadas superficiais sua associação com os oxi-hidróxidos de Fe(III) formam compostos que apresentam baixa solubilidade e migram para camadas mais profundas (sedimento). Nessas camadas os oxi-hidróxidos de Fe(II), mais solúveis que os compostos de Fe(III, são formados, com a liberação do fosfato, estabelecendo um ciclo onde o fósforo migra novamente para as camadas superficiais.”
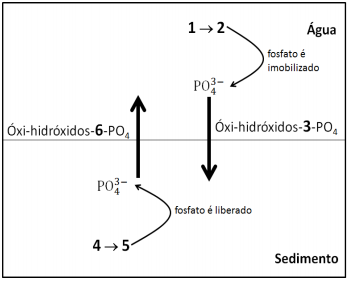
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Agente oxidante é uma espécie que fornece elétrons a
uma substância que está sendo reduzida (e ela própria
sendo oxidada) em uma reação de oxirredução. Agente
redutor é a espécie que remove elétrons da espécie que
está sendo oxidada (e ele próprio é reduzido) em uma
reação de oxirredução.
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Eletroquímica é o ramo da química que trata do uso de
reações químicas para produzir eletricidade, das forças
relativas dos agentes oxidantes e redutores e do uso da
eletricidade para produzir mudança química.