Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Ao efetuar o balanceamento da reação acima, a soma dos menores coeficientes inteiros da reação será:
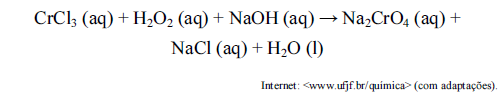
A respeito da reação de oxirredução não balanceada citada no texto acima, assinale a opção correta.
A análise titrimétrica desempenha um papel importante na análise quantitativa. Os diferentes métodos titrimétricos são classificados em função das reações que ocorrem durante a titulação. O permanganato de potássio, o ácido etilenodiaminotetracético e o cloreto de prata são comumente empregados, respectivamente, nas análises titrimétricas denominadas reações de:
Um analista utilizou para a determinação de Fe3+ uma solução de Mg-EDTA. Em uma primeira etapa, ocorre a seguinte reação:
Fe3+ + MgY2- → FeY- + Mg2+
Posteriormente, os íons Mg2+ são titulados com solução padrão de EDTA. Assinale a opção que apresenta o nome correto do procedimento adotado para essa titulação com EDTA.
Considere a pilha galvânica Cd(s)|Cd(NO3)2(aq)||AgNO3(aq)|Ag(s).
Os potenciais-padrão de redução, de cada meia-célula, em relação ao Eletrodo Padrão de Hidrogênio são dados abaixo:
Cd2+(aq) + 2e- → Cd(s) Eº = -0,402 V
Ag+(aq) + e- → Ag(s) Eº = +0,799 V
Sabe-se que o potencial padrão de redução do eletrodo de calomelano em relação ao eletrodo padrão de hidrogênio é +0,268 V.
Assim, assinale a opção que apresenta o potencial de redução do cátodo da pilha supracitada em relação ao eletrodo de calomelano, em Volts.
Observe a figura abaixo e considere a seguinte reação de eletrólise de NaCI aquoso 1 mol L-1:
Semicélula: 2Cl-(aq) → Cl2(g) + 2e-
Semicélula: 2e- + 2H2O → H2(g) + 2OH-(aq)
Célula: 2H2O(aq) + 2Cl-(aq) → H2(g) + Cl2(g) + 2OH-(aq)
Com base nas informações pode-se afirmar que:
Considere a célula eletroquímica abaixo.
A diferença de potencial elétrico da célula é dada por: E= 0,5580 + 0,05916 log([Ag+]), em Volts.
Na titulação de 30mL de uma solução de KCI 0,4M foi usada uma solução de AgNO3 0,15M. Sabendo que a diferença de potencial elétrico foi medida pela célula acima, assinale a opção que apresenta o valor da diferença de potencial elétrico, em Volts, após a adição de 20ml da solução de AgNO3.
Dado: KPS,AgCI = 1,8 x 10-10
Em relação à oxirredução, marque a opção INCORRETA:
Nas reações químicas podem ocorrer a oxidação, quando uma substância ou espécie perde elétrons, e a redução, quando uma substância ou espécie ganha elétrons. A seguir, tem-se o exemplo de uma reação redox:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCI + 3H2O
Com base nisso, analise as afirmativas abaixo, colocando V (verdadeiro) ou F (falso) e assinalando a seguir a opção correta.
I- A variação no número de oxidação do manganês, Mn, muda de +4 para +6, perdendo dois elétrons.
lI- Nenhuma espécie ou substância sofre redução nesta reação.
Ili- O CI5+ é um agente oxidante, já o Mn4+ é o agente redutor.
IV- A equação não está eletronicamente balanceada.
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
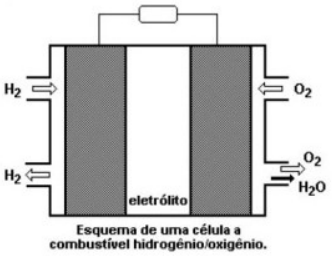
Sobre a pilha de hidrogênio, pode-se afirmar que
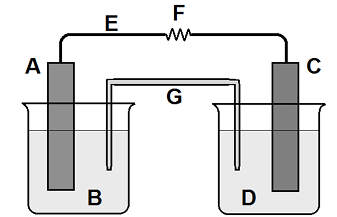
Legenda da figura: (A) placa de estanho, (B) solução aquosa contendo íons Sn2+, (C) placa de alumínio, (D) solução aquosa contendo íons Aℓ3+, (E) fio metálico, (F) resistência elétrica e (G) ponte salina.
Considerando os seguintes dados:
E°(Sn2+/Sn) = -0,14 V E°(Aℓ3+/Aℓ) = -1,68 V
Durante o funcionamento da pilha, o estudante fez algumas afirmações:
I. A concentração de íons alumínio aumenta na solução da direita (D). II. Na placa de alumínio ocorre a corrosão. III. O fluxo de elétrons ocorre pelo fio metálico a partir da placa de estanho em direção à placa de alumínio. IV. Na placa de estanho ocorre a redução. V. A placa de estanho é o polo negativo da cela galvânica.
Dessas afirmações,
I. O polo positivo de uma célula eletrolítica chama-se catodo.
II. O processo de oxidação ocorre no anodo.
III. A pilha seca de zinco-carbono é um exemplo de aplicação prática dos processos eletroquímicos.
IV. Uma reação que no sentido desejado apresente ΔE° > 0 não será espontânea.
Estão corretas as sentenças:
[Feº (s) l Fe2+ (aq) (1 mol/ L) II Pb2+(aq) (1mol/L) I Pbº (s) ]
Nessa pilha, a espécie química que atua como oxidante é:
I. A corrosão eletroquímica é o tipo de corrosão mais comum, pois é a que ocorre com os metais, geralmente na presença de água. II. O reator tubular é um exemplo de equipamento para reação química utilizado na indústria química. III. Na Internet, ao criar uma senha, é recomendável usar apenas números, em uma combinação de até 5 caracteres. Marque a alternativa CORRETA:
I. Os alcanos contêm somente C e H em ligações simples na sua estrutura. II. A corrosão eletrolítica é um processo eletroquímico que ocorre pelo efeito da radiação solar nos metais. III. O conceito de parâmetro, em estatística, inclui os valores singulares que existem na população e que impedem a sua caracterização. Marque a alternativa CORRETA:
I. A série química dos metais alcalinoterrosos inclui elementos que reagem com facilidade com a água para formar hidróxidos fortemente básicos. II. Existem três tipos de corrosão, a corrosão eletrolítica, a corrosão química e a corrosão eletroquímica. III. A corrosão química é o ataque de algum agente físico diretamente sobre determinado material, que pode ou não ser um metal. Marque a alternativa CORRETA:
Na reação 2 MnO4 - + 3 H2O2 + 2H+ → 2 MnO2 + 3 O2 + 4 H2O, o agente redutor e o NOX do elemento químico que sofre redução, são, respectivamente:
