Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
Julgue o seguinte item, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
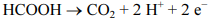
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 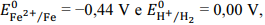 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
Dado F = 96.500 C mol-1
Na determinação potenciométrica de K+, utilizou-se um sistema composto por um eletrodo seletivo de membrana com vanilomicina e um eletrodo de referência de Ag|AgCl(LiCl(sat)).
Nesse sistema, o sinal que é relacionado com a concentração de analito é da(o)
4Fe(s) + 3O2(g) + 2H2O(l) → 2Fe2O3.H2O(s)
Uma das maneiras de evitar esse fenômeno é
Assinale a alternativa que cujas palavras ou expressões completam corretamente as lacunas da frase.
A Lei de Faraday da eletrólise enuncia que “a quantidade do produto formado ou do reagente consumido por uma corrente elétrica é estequiometricamente equivalente à quantidade de elétrons fornecidos”. Pode-se afirmar, portanto, que a quantidade (em mols) de Al(s) que pode ser produzida a partir do alumínio no composto Al2O3, se 5 mols de elétrons forem fornecidos, é aproximadamente:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
O ácido ascórbico (AA) é uma cetolactona, presente em frutas cítricas, tomate e vegetais de folhas verdes. O AA atua em reações de oxirredução em pelo menos 10 sistemas enzimáticos e na captura de radicais livres:
C6H8O6 + 2H+ + 2NO2 ⟶ C6H6O6 + 2H2O + 2NO
Qual dos seguintes pares identifica os agentes redutores e oxidantes, respectivamente?
Julgue o item que se segue.
O íon Cr3+ pode ser convertido no íon Cr6+ em meio
aquoso, espécie muito ácida que pode alterar
expressivamente o pH do meio, podendo trazer danos à
vida aquática e aos seres humanos.
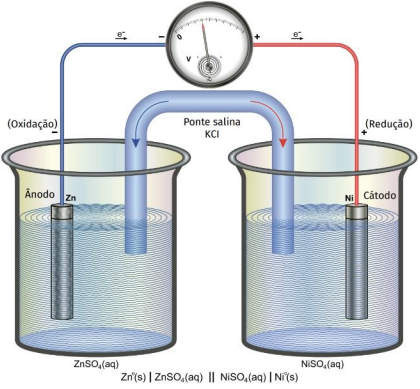
BrO3 - (aq) + 6 H+ (aq) + 6 e- → Br- (aq) + 3 H2 O (l) Eo red = +1,44 V
I2 (s) + 2 e- → 2 I- (aq) Eº red = +0,54 V
Em relação à pilha formada, observa-se que
A relação entre essas grandezas é expressa por
Nessa eletrólise, a substância simples formada no catodo é
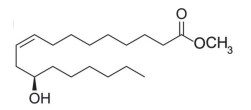
De acordo com as regras de nomenclatura da IUPAC, o nome do ricinoleato de metila é
Zn | Zn2+ (0,0010 M) | | Cu2+ (0,0010 M) | Cu
No laboratório, foram realizados três experimentos independentes para avaliar o comportamento dessa pilha galvânica, sendo eles:
(i) Adição de um excesso de amônia (NH3(g)) 1,0 M no compartimento catódico.
(ii) Adição de um excesso de amônia (NH3(g)) 1,0 M no compartimento anódico.
(iii) Adição de um excesso de amônia (NH3(g)) 1,0 M nos dois compartimentos simultaneamente.
De acordo com as condições mencionadas acima, assinale a alternativa correta quanto ao comportamento da pilha galvânica:
O caso descrito é um exemplo de eletrólise