Questões de Concurso
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 710 questões
A figura apresenta um dispositivo empregado em potenciometria.

Trata-se de um eletrodo
A tabela a seguir apresenta as equações de quatro reações.

As reações em que ocorrem oxirredução são as de números
Cu + NO3- + H+ ↔ Cu2+ + NO + H₂O
I. A sequência correta dos coeficientes estequiométricos de cada uma das substâncias, na ordem em que elas aparecem na reação acima, é 3; 2; 8; 3; 2; 4.
וו. O Cu se reduz e o NO3- se oxida.
ווו. O Cu ganha 2 elétrons e a NO3- perde 3 elétrons.
IV. O Cu é o agente redutor e a NO3- é o agente oxidante.
V. A soma da carga dos reagentes é diferente da soma das cargas dos produtos.
Assinala a alternativa que apresenta somente afirmativas corretas:
As reações envolvidas são:
O2 + 2Mn2+ + 4OH- ↔ 2MnO2 + 2H2O
MnO2 + 2l- + 4H+ ↔ Mn²+ + l2 + 2H2О
l2 + 2S2O32- ↔ 2I- + S4O62-
Com base nas informações acima, assinala a alternativa correta.
2e- + 2H+(aq) → H2(g)
Com base nos dados apresentados e, ainda, considerando a constante de Faraday como 96.500 C/mol, é correto afirmar que a corrente média aplicada durante a eletrólise foi de, aproximadamente:
2Cl−(aq) → Cl2(g) + 2e−
Para isso, André ajustou o equipamento para operar com uma corrente elétrica constante de 5,0 A, mantendo o sistema ativo por 1.930 segundos (~ 32 minutos). Considerando que a constante de Faraday é de 96.500 C/mol, a quantidade de matéria (mol) de gás cloro produzida foi de, aproximadamente:
I. Nas células eletrolíticas, a energia química é convertida em energia elétrica.
II. Assim como a entropia, processos espontâneos são acompanhados por uma variação positiva na energia de Gibbs (∆G).
III. Ao multiplicar por dois a semirreação “Fe2+(aq) → Fe3+(aq) + e- ; E°= – 0,77V”, o valor do potencial padrão não deverá ser alterado.
Está correto o que se afirma apenas em
Fe2+ + 2e−→ Fe
Qual é a quantidade de carga elétrica (em Coulombs) necessária para essa remoção? Considere a constante de Faraday como F=96.485 C/mol.
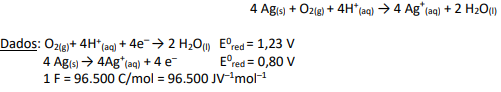
O valor da variação de energia livre, ∆G0 e a espontaneidade da reação é:
I. Na reação química As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO, o nitrogênio sofre redução.
II. Na reação Cl2(g) + NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l), o cloro sofre, ao mesmo tempo, oxidação e redução, tratando-se, nesse caso, de uma reação de auto-oxirredução.
III. Na equação química MnO4- + Fe2+(aq) + H+ (aq) → Mn2+(aq) + H2O + Fe3+(aq), a soma dos menores valores inteiros dos coeficientes estequiométricos é 24.
Está correto o que se afirma em
I. Na eletrólise do sulfato de sódio, a água é mais facilmente oxidada no ânodo do que o SO4- e no catodo as moléculas de água são reduzidas mais facilmente que os íons sódio.
II. Na eletrólise do cloreto de sódio fundido, pode-se obter Cl2(g) no ânodo.
III. Na eletrólise de uma solução aquosa de NaF, o F– será reduzido.
Está correto o que se afirma em
Fe2+(aq) + 2 e– → Fe(s) Eo = – 0,44 V
Zn2+(aq) + 2 e– → Zn(s) Eo = – 0,76 V
Com base nos dados de potencial-padrão de redução das semirreações, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O zinco é mais facilmente oxidado e serve como ânodo.
( ) O ferro funciona como cátodo.
( ) O potencial desta pilha é 1,2 V.
( ) O ∆Eo < 0 caracteriza o funcionamento espontâneo da pilha.
A sequência está correta em
Acerca das transformações da matéria, julgue o item seguinte.
Quando uma corrente elétrica passa através da água líquida, ela é decomposta em suas substâncias elementares: gás hidrogênio e gás oxigênio. Esse processo de eletrólise está descrito pela equação química a seguir.
H2O (l) → H2 (g) + ½ O2 (g)
Com base nos fundamentos de eletroquímica, analise as assertivas a seguir e assinale V, se verdadeiras, ou F, se falsas.
( ) Na eletrólise ígnea do NaCl, após o processo de dissociação, quando a fonte de energia elétrica é ligada, o cátion (Na+) desloca-se em direção ao cátodo, e os ânions (Cl-) deslocam-se em direção ao ânodo.
( ) Na eletrólise aquosa do NaCl, os cátions H+ sofrem redução e transformam-se no gás H2, e os ânions Cl- sofrem oxidação e transformam-se no gás Cl2.
( ) Pilha é um dispositivo no qual ocorre produção de corrente elétrica a partir de energia química oriunda de uma reação de oxidação e redução.
( ) Na eletrólise ocorre uma reação de oxidação e redução espontânea.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Dados: Constante de Faraday F = 9,5 x 104 C mol-1 Massas molares: Ca: 40 g mol-1; Cl: 35 g mol-1