Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
AgNO3 (aq) + KI (aq) ? AgI (s) + KNO3 (aq)
Levando-se em conta a estequiometria da reação e o conceito de reagente limitante, e sendo as massas molares do AgNO3 = 170 g/mol e do KI = 166 g/mol, após a reação
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco
K2 Cr 2 O7 (aq) + FeSO4 (aq) + H2 SO4 (aq) ? Cr 2 (SO4 ) 3 (aq) + Fe2 (SO4 ) 3 (aq) + K2 SO4 (aq) + H2 O
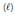
Nessa equação, verifica-se que
Pode-se dizer que x e Y são, respectivamente,
aHg + bHNO3 → xHg(NO3 ) 2 + yH2 O + zNO
A soma dos coeficiente x, y e z, após o balanceamento, é
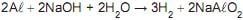
A quantidade de gás hidrogênio, em mol, obtido, nesse experimento, é, aproximadamente,
Assinale a opção que contém a fórmula química desses sais, respectivamente.
CrO4 2– + I ¯ → Cr3++ I2 + H2O
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
 Os menores coeficientes a, b, c, d, e e f que balanceiam esta equação correspondem, respectivamente, a:
Os menores coeficientes a, b, c, d, e e f que balanceiam esta equação correspondem, respectivamente, a: 
A quantidade mínima de moléculas de cloro para equilibrar essa reação, obedecendo às leis estequiométricas, é igual a:
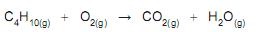
A massa de butano, em gramas, que mais se aproxima do valor que dá origem a 67,2 L de CO2 , nas condições normais de temperatura e de pressão, e considerando o comportamento de gás ideal (no qual o volume molar é igual a 22,4 L), é
Fe (s) + O2 + H2 O (vapor) → Fe(OH)2 Fe(OH)2 + O2 (g) → Fe2 O3 H2 O (vermelha ou castanha) + H2 O
Fe(OH)2 → Fe3 O4 (preto)+H2 O +H2 Nas reações descritas pelas equações acima, observa-se que o ferro
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 mol•L–1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
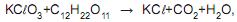 a quantidade, em gramas, de cloreto de potássio formada quando reagem 2,0 mols de
a quantidade, em gramas, de cloreto de potássio formada quando reagem 2,0 mols de 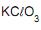 é de, aproximadamente,
é de, aproximadamente,
