Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
Bi2 O3 + NaClO + NaOH → Na BiO3 + NaCl + H2O
Na síntese de um composto orgânico foram empregados 1,2 g de carbono, 0,2 mol de hidrogênio e 1,81 x 1023 átomos de oxigênio. A fórmula mínima do composto em questão é:
Dados: C=12; H= 1 e O = 16
Um composto é formado de 92,32% de carbono e 7,68% de hidrogênio. Nas condições normais de temperatura e pressão (CNTP), 11,2 L de seu vapor pesam 39 g. A sua fórmula molecular é:
Dados: C=12 e H=1.
 que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado.
que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado. O teor de carbonato de cálcio na amostra de minério analisada é
O íon nitrato é um ânion poliatômico. Possíveis estruturas de Lewis são construídas a partir da fórmula NO3- , como mostradas a seguir:
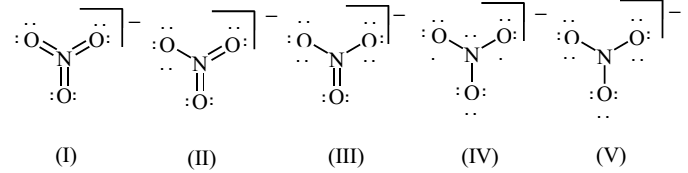
A fórmula de Lewis correta e mais estável do íon nitrato é:
Um método clássico da química analítica de medir o teor de água oxigenada é a reação da água oxigenada com íon permanganato, que é reduzido a Mn+2, em meio ácido, de acordo com a equação a seguir (não balanceada).
KMnO4(aq) + H2O2(aq) + H+ (aq) → Mn2+ (aq) + H2O(l) + O2(g)
Um analista recebeu em um Erlenmeyer um volume de 10 mL de uma amostra de água oxigenada e acrescentou 100 mL de água destilada. A análise foi feita utilizando 15,3 mL de uma solução padrão de permanganato de potássio padrão 0,1103 mol/L. (Considere as seguintes massas moleculares (g/mol): Mn = 55; H = 1; O = 16; K = 39.)
O teor de H2O2 na amostra anterior, expresso em g% (m/V), e o de mol/L são, respectivamente,
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
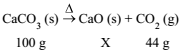
A massa, em gramas, correspondente a X é igual a
O volume, em litros, obtido do produto quando são consumidas 2,71x1024moléculas de Hidrogênio, nas CNTP, é igual a: