Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
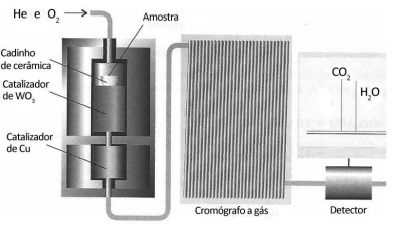
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
Ca5 (PO4)3F (s) + H2SO4 (aq)
 Ca(H2PO4
)2
(aq) + CaSO4
(aq) + HF (g)
Ca(H2PO4
)2
(aq) + CaSO4
(aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta equação é
CNTP: 1 atm e 273 K R = 0,082 atm L mol-1 K-1
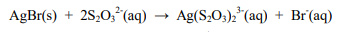
O volume, em mL, de uma solução de Na2S2O3 0,1 molL-1 necessário para solubilizar 0,18 g de AgBr é de aproximadamente:
[Dados: Massas atômicas: Ba 137,327 g mol⁻¹; Cl 35,45 g mol⁻¹; H 1,008 g mol⁻¹; O Ba 15,999 g mol⁻¹]
A fórmula química do sal hidratado é:
Algumas baterias primárias e secundarias comercializadas no país, ainda podem conter em sua composição metais pesados altamente tóxicos, como o Pb, Hg e Cd. A bateria de chumbo é um exemplo de bateria secundária ou recarregável. Dentre suas diversas aplicações, ela é responsável pela ignição e funcionamento da parte elétrica dos automóveis, pelo tracionamento de alguns motores elétricos e por manter em funcionamento alguns equipamentos em caso de queda do fornecimento de eletricidade (no-break).
A equação PbO2 (s) + H2SO4 (aq) + Pb(s) → PbSO4(s) + H2O (l), não balanceada, representa essa bateria. Pode-se afirmar que: