Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
A reação química 2H2(g) + 2NO(g) 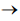 N2(g) + 2H2O(g) ocorre em duas etapas:
N2(g) + 2H2O(g) ocorre em duas etapas:
etapa 1: H2(g) + NO(g) + NO(g) 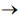 N2O(g) + H2O(g)
N2O(g) + H2O(g)
etapa 2: H2(g) + N2O(g) 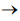 N2(g) + H2O(g)
N2(g) + H2O(g)
Sobre essas reações químicas, é CORRETO afirmar que na etapa
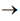 (NH4)3H4P(Mo2O7)6 + H2O
A soma dos coeficientes estequiométricos dessa equação química, após o correto balanceamento, é igual a
(NH4)3H4P(Mo2O7)6 + H2O
A soma dos coeficientes estequiométricos dessa equação química, após o correto balanceamento, é igual a C8H18(
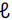 ) + O2(g) → CÜ2(g) + H2O(v)
) + O2(g) → CÜ2(g) + H2O(v)
Considere que após uma hora e meia de reação foram produzidos 72 mols de CO2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por minuto, é de:
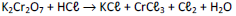
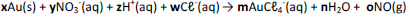
Onde x, y, z, w, m, n e o são coeficientes estequiométricos. Sobre essa reação assinale a alternativa CORRETA:

O carbonato de cálcio é um composto de extrema importância comercial, utilizado na fabricação de cimento, em cremes dentais e até para diminuir a acidez dos vinhos. Dada a reação de decomposição do carbonato de cálcio CaCO3(s)→ CaO(s) + CO2(g), se fossem usados 30g de CaCO3, o volume de CO2 obtido, considerando-se as CNTP, seria de (Dados: Massas molares g/mol: Ca = 40; C = 12; O = 16.)
Com relação aos significados de mistura, molécula e substância, julgue o item a seguir.
Molécula é a menor porção de um composto, com um
grupo variável de átomos ligados em um arranjo mutável
e eletricamente neutro.
2 H₂ + 2 NO → N₂ + 2 H₂O
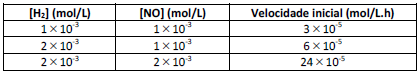
Marque a alternativa que apresenta a lei de velocidade que concorda com os dados experimentais.
