Questões de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas para Concurso
Foram encontradas 553 questões
Um estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
A molécula da anandamida é capaz de aliviar a ansiedade e induzir a uma situação de tranquilidade e relaxamento. O chocolate é uma das fontes dessa substância.
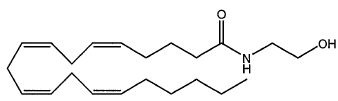
A fórmula molecular desse composto é a seguinte:
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) 2 NO(g) + O2(g) → 2 NO2(g) 3 NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
Supondo-se que o rendimento esperado nesse processo seja de 90% e que a amônia utilizada apresente 20% de impurezas, a massa de amônia, em toneladas, necessária para obtenção de 6,3 t de ácido nítrico será de, aproximadamente:


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a
176,0 g/mol.
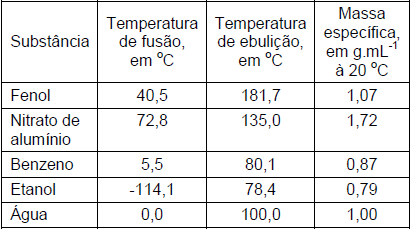
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
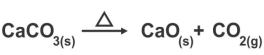
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?