Questões de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas para Concurso
Foram encontradas 553 questões
Em relação à nomenclatura química de ácidos, bases e sais, julgue o item a seguir.
O sal sulfato cúprico penta-hidratado possui
a fórmula molecular CuSO4
.5H2O.
Os diferentes tipos de átomos podem se reunir das mais variadas maneiras, formando uma infinidade de agrupamentos diferentes ou os aglomerados iônicos, e cada molécula representa uma substância pura ou espécie química. Sobre as substâncias químicas, elementos e misturas, julgue o item a seguir.
O gás oxigênio e o gás ozônio são formas
alotrópicas do elemento oxigênio.
Os diferentes tipos de átomos podem se reunir das mais variadas maneiras, formando uma infinidade de agrupamentos diferentes ou os aglomerados iônicos, e cada molécula representa uma substância pura ou espécie química. Sobre as substâncias químicas, elementos e misturas, julgue o item a seguir.
A substância permanganato de potássio é
composta por 6 elementos.
É comum, nos laboratórios químicos, efetuar a mistura de duas (ou mais) soluções de um mesmo soluto, ou a mistura de soluções cujos solutos reagem entre si. A respeito desse assunto e os cálculos relacionados, julgue o item a seguir.
Misturando-se 300 mL de HCl 0,4 M a
200 mL de NaOH 0,6 M, a solução final
apresentará excesso de um dos reagentes.
Em relação às reações de neutralização, as quais formam diversos tipos de sais, julgue o item a seguir.
A reação, devidamente balanceada, entre ácido fosfórico e hidróxido de cálcio, é expressa por:
2 H3PO3
+ 3 Ca(OH)2
→ Ca3(PO3
)2
+ 6 H2O
Sobre as características dos ácidos de grande importância industrial, julgue o item a seguir.
O HCl puro é conhecido como gás clorídrico
ou cloridreto ou cloreto de hidrogênio.
Zn + 2HC1 → ZnCl2 + H2
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
Após analisar as afirmativas de I a V, assinale a alternativa correta:
Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
6NH4 ClO4 (s) + 10Al (s) → 5Al2 O3 (s) + 3N2 (g) + 6HCl (g) + 9H2O (g)
Considerando que se colocou para reagir 1 kg do perclorato de amônio com 1 kg do alumínio, quanto, aproximadamente, de massa, em gramas, do óxido foi produzido na reação?
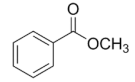 Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é:
Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é:Análises químicas mostraram que um lote de carvão específico contém 2% de enxofre em massa. Quando esse carvão é queimado, o enxofre é convertido em gás dióxido de enxofre.
Considerando que nesse processo todo o dióxido de enxofre produzido da queima do carvão reagiu completamente com óxido de cálcio produzindo 2 mil toneladas de sulfito de cálcio, é correto afirmar que a massa aproximada, em toneladas, de carvão queimado é:
Analise as seguintes reações de oxirredução:
I. _ H2 S(g) + _ SO2 (g) → _ S(s) + _ H2 O(l)
II. _ B2 O3 + _ Mg(s) → _ B(s) + _ MgO(s)
A alternativa que representa as equações balanceadas é:
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 . Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.


