Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 555 questões
Uma das formas de obtenção do fosfato de cálcio pode ser através da reação:
CaCO3(aq) + Mg3(PO4)2(aq) Ca3(PO4)2(aq) + MgCO3(aq)
Considerando que a reação tem um rendimento de 80%, qual a massa de fosfato de cálcio, em gramas, será obtida quando são utilizados 450 g de carbonato de cálcio (70% de pureza)?
Dados: Ca = 40 g/mol; C = 12 g mol-1 ; O = 16 g mol-1 ; Mg = 24 g mol-1 ; P = 31 g mol-1 ; Ca = 40 g mol-1.
Cd2+ + 2 e- → Cd Eo red = - 0,40 V
Dado: Massa molar C6H8O7 = 192 g.mol-1 C6H8O7(aq) + 3 OH-(aq) → C6H5O73-(aq) + 3 H2O
I. 2Fe2O3(s) + 3C(g) →4Fe(s) + 3CO2(g) II. Zn(s) + 2H+ (aq) → Zn2+ (aq) + H2(g) III. 4Al(s) + 3O2(g) → 2Al2O3(s)
Considerando que uma amostra de 2,0 kg, contendo 80% de óxido de cobre II, foi utilizada para reagir com o ácido citado no livro de Stephen King. Admitindo que os outros compostos da amostra não reagem com o ácido, determine a massa aproximada de ácido necessária para que todo o cobre da amostra sofra reação química.
Considere as seguintes massas molares em g.mol-1 : Cu = 63,5; O = 16; H = 1 e S = 32.
SnS + HCℓ + HNO3 → SnCℓ4 + S + NO + H2O
Após o balanceamento da equação, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas na reação é
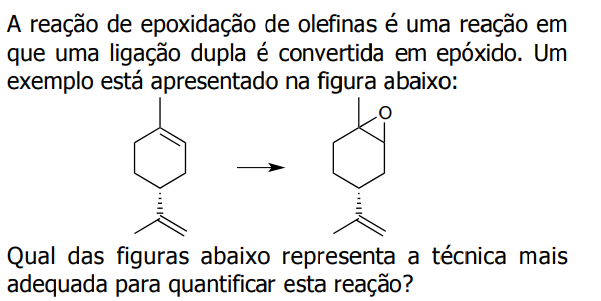
Uma reação de precipitação a partir da mistura de duas soluções pode ser escrita representando-se todos os íons
envolvidos ou somente os íons que realmente participam da reação, omitindo-se os íons espectadores. Assim, a reação
de precipitação de cromato de prata a partir de uma solução de cromato de potássio e de uma solução de nitrato de
prata pode ser escrita na forma completa e na forma resumida, respectivamente, como:
Em relação a essa operação é correto dizer que
Fe2(SO4)3 + NaOH → Fe(OH)3 + Na2SO4
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a
A Lei das Proporções Definidas é também conhecida como Lei de Proust. Esse estudioso observou que amostras de compostos diferentes, de massas iguais, contêm sempre a mesma proporção em massa dos seus elementos constituintes. Desse modo, as proporções em massa dos elementos constituintes são fixas para quaisquer compostos distintos.
A Lei da Conservação das Massas, ou Lei da Conservação da Matéria, é observada e difundida no meio científico pela realização de experimentos em recipientes fechados e com balanças precisas; a soma das massas antes de uma reação é igual à soma das massas após a reação.
É consenso entre os estudiosos da área que o início da química como área de conhecimento deu-se com o trabalho de Robert Boyle (1627-1691), considerado o “pai” da química.
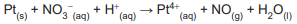
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
O processo de obtenção consiste na calcinação da mistura de sílica (SiO2) com carbonato de sódio (Na2CO3), produzindo o silicato de sódio e gás carbônico. Este processo apresenta rendimento de 70%.
A massa de silicato de sódio que poderá ser obtida por este processo, a partir de 3,0 kg de sílica, é: Dados: Massas molares em g.mol–1 Si = 28; O = 16; Na = 23; C = 12.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Acerca de estequiometria, julgue o item que se segue.
As bases fundamentais da estequiometria são a lei das
proporções definidas, a lei das proporções múltiplas e a lei
das proporções equivalentes.

