Questões de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas para Concurso
Foram encontradas 553 questões
A alternativa que apresenta os coeficientes estequiométricos na ordem a, b, c, d, e, f, g que respeitam a reação de oxirredução a seguir é:
a KMnO4 + b H2S + c HCl
→ d MnCl2 + e S + f H2O + g KCl
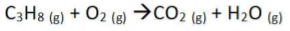
O balanceamento da equação é dado pelos coeficientes estequiométricos, nesta ordem:
Considere as substâncias a seguir para responder à questão.


Para identificação de um óxido de nitrogênio desconhecido foram analisadas, por meio da decomposição, três amostras dessa substância química. Os dados obtidos durante a análise foram organizados de acordo com a tabela.
Uma análise dessas informações e dos dados da tabela
permite concluir:
H2 O2(aq) + KMnO4(aq) + H2 SO4(aq) → K2SO4(aq) + MnSO4(aq) + H2O(l) + O2(g)
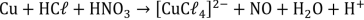
A soma dos menores coeficientes inteiros que balanceiam a equação é:
Ao efetuar o balanceamento da reação acima, a soma dos menores coeficientes inteiros da reação será:
a I2 O5 (s) + b CO(g) ⥨ c I2 (g) + d CO2 (g) e I2 (aq) + f S2 O3 2-(aq) ⥨ g I- (aq) + h S4 O6 2-(aq)
Após balanceadas as equações, é CORRETO afirmar sobre os coeficientes de balanceamento que
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
A estequiometria correta da equação química apresentada é obtida com os seguintes valores para x, y e z, respectivamente: 6, 2 e 3.
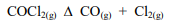
A decomposição do fosgênio é intensificada se:
Determine a soma dos menores coeficientes estequiométricos inteiros capazes de balancear a seguinte equação:
H2O2 + N2H4 → HNO3 + H2O
Na + H2O → NaOH + H2
No balanceamento dessa reação, tem-se molécula(s) de sódio e de água que resulta(m) em hidróxido de sódio e hidrogênio molecular na respectiva proporção de
Observe a reação.
Fe2O3 + CO → Fe + CO2
Considerando essa reação não balanceada, quantos gramas de óxido de ferro (Fe2O3) são necessários para a produção de 4 mols de ferro (Fe) em uma reação balanceada?
Dados:
Massa molecular (Fe2O3) = 160 g/mol;
massa molecular (Fe) = 56 g/mol