Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Diante dessas informações, essa reação irá produzir Dado: R (constante dos gases ideais) = 0,08 L·atm·mol−1 ·K−1.
CO(g) + H2(g) → CH3OH(l)
Ni(s) + CO(g) → Ni(CO)4(g)
Considerando as massas molares, em g/mol, do Ni = 59, C = 12 e O = 16, qual a massa de Ni(CO)4 obtida, em kg, aproximadamente, dado que 20 kg de níquel metálico foram volatilizados?
Um produto químico comum, o tricloroetileno, pode estar associado a um aumento do número de casos de doença de Parkinson no mundo, garante um grupo de cientistas internacionais. Este composto é um solvente usado para descafeinar café, desengordurar metais e lavar roupas a seco.
Adaptado de: https://oglobo.globo.com/saude/medicina/noticia/2023. Acesso em 02/04/2023.
Assinale a opção que indica a fórmula molecular do produto químico citado no texto.
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
Esse alerta tem sido feito pelos Conselhos Regionais de Química frente às informações veiculadas nas mídias digitais. A mistura de água sanitária com vinagre, por exemplo, produz gás cloro que é altamente tóxico.
Os princípios ativos encontrados nos dois produtos citados são
Gregos teriam decorado seus vasos funerários com gesso, revela estudo
“Um estudo realizado por pesquisadores da Universidade de Palermo, localizada na Itália, descobriu que os antigos gregos teriam usado gesso para fazer algumas das pinturas presentes em seus vasos funerários (...). Eles puderam identificar sulfato de cálcio (origem do gesso) nas figuras brancas presentes em vasos de fundo preto ou vermelho, o que lhes permitiu entender melhor o processo de desenvolvimento desses objetos artísticos”. (Adaptado)”
Fonte: https://aventurasnahistoria.uol.com.br/noticias/historia-hoje/gregosteriam-decorado-seus-vasos-funerarios-com-gesso-revela-estudo.phtml. Acesso em 10/01/2023
A fórmula molecular da substância química identificada nas figuras dos vasos funerários é:
1ª. Etapa: S + O2 → SO2 2ª. Etapa: SO2 + O2 → SO3 3ª. Etapa: SO3 + H2O → H2SO4
Ao fazermos o balanceamento para as 2ª e 3ª etapas, utilizando somente os menores coeficientes inteiros, assinale a alternativa correta.
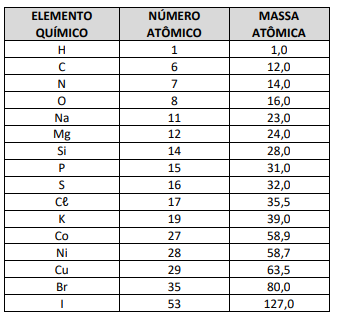
Uma das formas da obtenção do gás nitrogênio é através da reação química do sódio com o nitrato de potássio. Sua equação química, não ajustada, é:
Na(s) + KNO3(s) → K2O(s) + Na2O(s) + N2(g).
Assinale a opção que corresponde aos coeficientes do par
das substâncias, reagente e produto.
Dados: N (Z=7); O (Z=8)
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
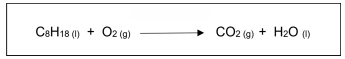
Para queimar completamente 2,00 mols de octano, serão necessários:
(MnO4) - (aq) + H2C2O4(aq) + H+ (aq) → Mn2+(aq) + H2O(l) + CO2(g)
A soma dos menores coeficientes inteiros que balanceiam a equação é: