Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 553 questões
Dados:
• H = 1 • N = 14
C6H14 + O2 → CO2 + H2O
A massa de oxigênio necessária para reagir completamente com 2 mols de hexano será de, aproximadamente:
Para cada mol de ácido fosfórico, são necessários três mols de hidróxido de sódio para produzir um mol de fosfato de sódio (Na₃PO₄) e três mols de água.
Na reação Cu(s) + 2Ag+(g) → Cu2+(aq) + 2Ag(s), o balanço de massa está correto, porém o balanço de carga está incorreto.
O hidrogênio tem capacidade de reagir com metais ativos para formar hidretos metálicos sólidos, como, por exemplo: 2Na(s) + H2(g) → 2NaH(s).
Quanto às reações químicas e suas representações, julgue o item.
Ao balancear a reação C6 H14 + O2 → CO2 + H2O, a soma dos menores coeficientes inteiros resultará em 47.
(1) Combustão. (2) Decomposição.
( ) 2H2O2 → 2H2O + O2 ( ) 2KBrO3 → 2KBr + 3O2 ( ) CH4 +2O2 → 2H2O + CO2
Fonte: MOLINARO, E.; CAPUTO, L.; AMENDOEIRA, R. Conceitos e métodos para formação de profissionais em laboratório de Saúde. Rio de Janeiro: EPSJV; IOC, 2009.
Julgue o item a seguir.
Todos os carboidratos possuem a fórmula química geral
(CH2O)n, onde ‘n’ representa um número inteiro.
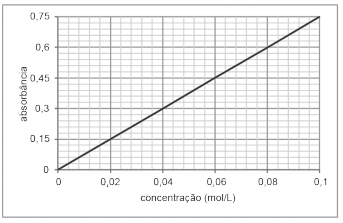
Uma amostra correspondendo a uma solução aquosa contendo Cu+2 passou pelo seguinte procedimento: uma alíquota de 10 mL dessa amostra foi completamente diluída em água até atingir um volume final de solução de 50 mL; uma alíquota dessa solução foi analisada no espectrômetro obtendo-se uma absorbância igual a 0,45.
A concentração de Cu+2 na amostra inicial, em mol L-1 , é
A amostra reagiu com uma solução de íons oxalato em excesso, acarretando a precipitação de MgC2 O4 , conforme apresentado na reação I. Considere que o magnésio foi o único componente da amostra a precipitar.
Em seguida, o precipitado foi filtrado, lavado e calcinado (reação II), gerando uma amostra sólida de 3,05 g.
Reação I: Mg2+ (aq) + C2 O4 2- (aq) → MgC2 O4 (s)
Reação II: MgC2 O4 (s) → MgO (s) + CO (g) + CO2 (g)
A concentração, em g L-1, de magnésio na amostra é
Dado massas molares: Mg = 24 g mol-1 , O = 16 g mol-1 , C = 12 g mol-1
Considerando essa reação, assinale a alternativa correta:
Considerar a reação de decomposição da água abaixo:
2 H2O ➝ 2 H2 + O2
Os números que indicam a proporção entre as quantidades
de moléculas em uma equação química são chamados de:
Etapa 1: 2 NO(g)
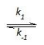 N2O2(g) (rápida, equilíbrio)
N2O2(g) (rápida, equilíbrio) Etapa 2: N2O2(g) + Br2(g)
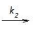 2NOBr (lenta)
2NOBr (lenta) A constante de velocidade para a reação entre óxido nítrico e bromo pode ser expresso em função das constantes k1, k-1 e k2 por meio da expressão:
Os primeiros relatos sobre o uso da pólvora se deram entre os chineses na Idade Média. A composição clássica desse material contém nitrato de potássio, carvão vegetal (carbono) e enxofre. Quando reagem entre si, esses compostos produzem nitrogênio gasoso, gás carbônico, carbonato de potássio e sulfato de potássio sólidos, além de grande quantidade de energia.
A soma dos menores inteiros que balanceiam corretamente a reação descrita é igual a
A fórmula molecular da referida substância orgânica é
Considerando que a estequiometria tem base em leis ponderais e compreende cálculos e regras para determinar a correta proporção das substâncias que se pretende utilizar, julgue o item a seguir.
A lei de Lavoisier, também conhecida como lei das
proporções constantes, tem como base o princípio de que a
soma das massas reagentes em um recipiente fechado é igual
à soma das massas dos produtos da reação.
Considerando que a estequiometria tem base em leis ponderais e compreende cálculos e regras para determinar a correta proporção das substâncias que se pretende utilizar, julgue o item a seguir.
Os coeficientes estequiométricos em uma reação química
podem ser determinados por tentativas; nesse caso, a fim de
melhorar a assertividade, são utilizadas algumas regras
empíricas, por exemplo, aquela em que se balanceiam, por
último, o carbono, o hidrogênio e o oxigênio, nessa ordem.
Com relação às reações químicas abaixo:
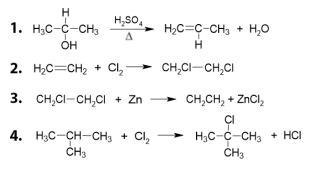
é correto afirmar que são, respectivamente, reações de
A fórmula estrutural deste antibiótico é mostrada a seguir:
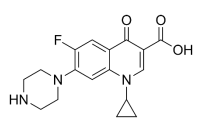
Com base na fórmula estrutural do ciprofloxacino, é correto afirmar que: