Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
Considerando que uma amostra de 2,0 kg, contendo 80% de óxido de cobre II, foi utilizada para reagir com o ácido citado no livro de Stephen King. Admitindo que os outros compostos da amostra não reagem com o ácido, determine a massa aproximada de ácido necessária para que todo o cobre da amostra sofra reação química.
Considere as seguintes massas molares em g.mol-1 : Cu = 63,5; O = 16; H = 1 e S = 32.
SnS + HCℓ + HNO3 → SnCℓ4 + S + NO + H2O
Após o balanceamento da equação, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas na reação é
Fe2(SO4)3 + NaOH → Fe(OH)3 + Na2SO4
Considere as substâncias a seguir para responder à questão.


Sobre esse experimento e os resultados observados, é CORRETO afirmar que no
Ca(OH)2 + HCI → CaCl2 + H2O
Com base nessa reação química, é correto afirmar que
Fe3O4 + CO (g) → FeO (s) + CO2 (g)
O sulfato de alumínio pode ser obtido a partir da reação representada na equação não balanceada:
Al2 O3 (s) + H2 SO4 (aq) → Al2 (SO4 )3(aq) + H2 O(l)
Quando o balanceamento da equação é feito usando-se o coeficiente 1 para Al2 O3 , os coeficientes para o H2 SO4 e para H2 O são, correta e respectivamente,
Zn + 2HC1 → ZnCl2 + H2
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
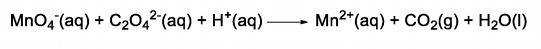
A semirreação de redução está corretamente representada em:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
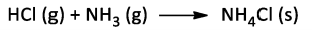
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Um acidente ambiental provocou a contaminação das águas de um estuário com chumbo. Uma amostra de 200,0 mL foi coletada para análise e todo o chumbo foi precipitado na forma de PbSO4 devido ao tratamento da amostra com ácido sulfúrico. Sabendo que a massa obtida de PbSO4 foi 6,06 mg, qual é a concentração de chumbo na amostra, em mg/L?
Massas molares (g/mol): O = 16; S = 32; Pb = 207.