Questões de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas para Concurso
Foram encontradas 553 questões
A fórmula estrutural de um hidrocarboneto é representada
a seguir:
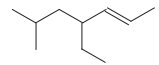
Este hidrocarboneto é nomeado
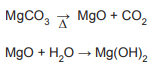
A massa de Mg(OH)2 obtida a partir de uma massa inicial de MgCO3 igual a 2,1 g é
Dados M(Mg) = 24,3 g mol-1 M(C) = 12,0 g mol-1 M(O) = 16,0 g mol-1 M(H) = 1,0 g mol-1
O balanço estequiométrico da reação
2KMnO4
(aq) + a HCl (aq) => b KCl (aq) + c MnCl2
(aq) + d H2O (aq) + e Cl2
(g)
fornece
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
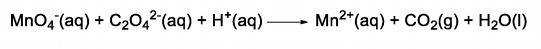
A semirreação de redução está corretamente representada em:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
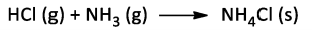
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Um acidente ambiental provocou a contaminação das águas de um estuário com chumbo. Uma amostra de 200,0 mL foi coletada para análise e todo o chumbo foi precipitado na forma de PbSO4 devido ao tratamento da amostra com ácido sulfúrico. Sabendo que a massa obtida de PbSO4 foi 6,06 mg, qual é a concentração de chumbo na amostra, em mg/L?
Massas molares (g/mol): O = 16; S = 32; Pb = 207.
O hidrogênio é um elemento que forma compostos binários com vários outros elementos, metais e ametais, formando substâncias com propriedades químicas e físicas muito variadas. Em alguns casos, formam-se hidretos, que são compostos em que o hidrogênio é o elemento mais eletronegativo. Abaixo são mostrados alguns compostos binários de hidrogênio:

Entre os exemplos citados, há quantos hidretos?
O ácido monoprótico, representado por HX, é misturado com excesso de Ba(OH)2 , reagindo segundo a equação abaixo.

Foram obtidos 15,00 g do produto BaX2 que foram quantitativamente reagidos com exatamente 59,00 mL de uma solução aquosa de ácido sulfúrico 1,00 mol L-1 , como mostrado na equação abaixo.
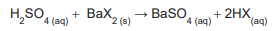
A partir dos dados do experimento, calculou-se a massa
molar de HX, em g mol -1
, e concluiu-se que era de 
Um volume de 1,00 mL de um adoçante líquido à base de sacarina sódica (representada por SacNa) foi colocado num Erlenmeyer, onde também se adicionou 100 mL de água pura. A sacarina sódica reagiu exatamente com 22,00 mL de uma solução padronizada de AgNO3 (0,500 mol L-1 ) para precipitar quantitativamente a sacarina, conforme equação abaixo. No resultado, já se considerou a correção do branco.
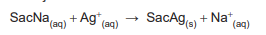
A concentração de sacarina, em g mL-1
, no adoçante, é
mais próxima de
O íon chumbo pode ser determinado por gravimetria, na forma de cromato de chumbo (PbCrO4(s)), usando agente de
precipitação homogênea. Isso é alcançado pela adição de excesso de cloreto de cromo (III), que produz o íon cromato ao
ser oxidado pelo bromato (BrO3 -), também adicionado em excesso. A sequência resumida de reações é indicada abaixo:
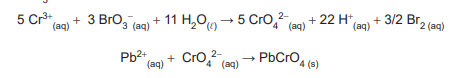
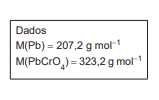
Uma alíquota de 60,000 g de resíduo foi totalmente dissolvido e submetido ao procedimento analítico gravimétrico em questão. A massa de 12,542 g de precipitado (após secagem até massa constante) foi obtida.
A percentagem (m/m) de chumbo presente na amostra foi de
Ácido sulfúrico em excesso foi adicionado a uma amostra de 150 g de alumínio metálico impuro, verificando-se a formação de 10 g de H2 , após a completa reação do alumínio.
Admitindo-se que as impurezas presentes não reagiram
com o ácido, o grau de pureza do alumínio é igual a
O óxido de zinco é um composto anfótero, reagindo tanto com ácidos fortes quanto com bases fortes.
O produto formado na reação do óxido de zinco com hidróxido de sódio tem a seguinte fórmula química:
Ao se borbulhar um óxido em uma solução aquosa de hidróxido de bário, observa-se a formação de um precipitado de carbonato de bário.
A fórmula química do óxido corresponde a
(volume molar = 22,4L em 25°C)