Questões de Concurso
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 572 questões
Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
Analise as seguintes reações de oxirredução:
I. _ H2 S(g) + _ SO2 (g) → _ S(s) + _ H2 O(l)
II. _ B2 O3 + _ Mg(s) → _ B(s) + _ MgO(s)
A alternativa que representa as equações balanceadas é:
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 . Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
O airbag, também conhecido como bolsa de ar, é um componente de segurança dos veículos automotores. O sistema de enchimento dessa bolsa é constituído por uma resistência elétrica e pela mistura de três substâncias: azida de sódio, nitrato de potássio e óxido de silício.
Internet: <chc.cienciahoje.uol.com.br> (com adaptações).
As fórmulas moleculares do nitrato de potássio e do óxido de silício, substâncias presentes no airbag, são expressas, respectivamente, por
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
O processo de lixiviação de metais não ferrosos origina uma lama rica em sulfeto de arsênio III (As2S3). Os compostos de arsênio são considerados tóxicos, por este motivo devem ser calcinados na presença de óxido de cálcio (CaO), gerando arseniato de cálcio (Ca3(AsO4)2) e sulfato de cálcio (CaSO4). Essa reação pode ser representada pela seguinte equação química não balanceada:
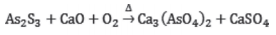
Após o balanceamento da equação, a soma
de todos os coeficientes mínimos e inteiros das
espécies químicas envolvidas é igual a:
A pílula anticoncepcional é fabricada com diferentes tipos de hormônios. Os mais usuais são o estrogênio e a progesterona. Nas pílulas de baixa dosagem hormonal é encontrado o etinilestradiol (C20H24O2), derivado sintético do estrogênio, em diferentes proporções. Um laboratório recebeu uma amostra contendo 2035 g de etinilestradiol contaminado e verificou que o grau de pureza do hormônio era de 80%. Como a purificação da amostra era inviável, foi constatada a necessidade de descartar todo o material recebido. O número de moles do hormônio que foram encaminhados para incineração é de:
Dados: H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
O silício é produzido a partir da reação do tetracloreto de silício com magnésio, conforme apresentado na equação química não balanceada a seguir.
SiCl4 (s) + Mg(s) → Si (s) + MgCl2 (s)
Considerando que 200 g de tetracloreto de silício reagem com excesso de magnésio, a massa de silício obtida, em gramas, é, aproximadamente, igual a
A equação química não balanceada, apresentada a seguir, demonstra a reação do permanganato de potássio com peróxido de hidrogênio em meio ácido.
mKMnO4 + nH2SO4 + oH2O2 → pK2SO4 + qH2O + rO2 + sMnSO4
Considerando o balanceamento adequado da equação, a somatória dos coeficientes estequiométricos dos reagentes é igual a
Determinado composto orgânico foi submetido à análise química e a porcentagem de cada elemento químico que o constitui foi determinada. Os resultados estão apresentados na tabela a seguir.

Com base nas informações apresentadas, a fórmula mínima do composto é:
A amônia pode ser preparada industrialmente pelo processo de Haber-Bosch, representado pela equação não balanceada a seguir.
N2(g) + H2(g) ⇌ NH3(g)
Supondo-se que a 300 ºC, esse experimento apresente concentração de N2 e de H2 de 0,3 e 2,0 mol L-1, respectivamente, e que a constante de equilíbrio Kc seja 10, a concentração de NH3, em mol L-1, nessa temperatura, deve ser, aproximadamente, de
A queima de gás metano ocorre conforme a equação abaixo:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(vapor)
Para a queima ao ar de 224 litros de metano, o volume total de ar utilizado na combustão e o volume total de gases e vapores ao final da combustão serão, respectivamente, de quantos litros?

O etanol, combustível utilizado como alternativa aos combustíveis fósseis, pode ser obtido através da fermentação da sacarose, conforme a equação NÃO balanceada mostrada abaixo:
C12H22O11 + H2O → C2H6O + CO2
Sabendo-se que a reação acima possui um rendimento de 80%, qual a massa de sacarose necessária, em toneladas, para a produção de 6.440 kg de etanol?

Dada a equação
Cu + HNO3 → Cu(NO3) 2 + H2O + NO
A soma total dos coeficientes mínimos inteiros de todas as espécies químicas envolvidas após o balanceamento da equação é
Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química: