Questões de Concurso
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 330 questões
Muitos íons metálicos formam complexos estáveis, solúveis em água, com muitas aminas terciárias. A formação desses complexos serve como base nas titulações complexométricas de íons metálicos.
Sobre as titulações complexométricas, assinale a alternativa INCORRETA.
No laboratório, foram avaliadas algumas propriedades de três substâncias, identificadas como 1, 2 e 3. Os resultados encontram-se dispostos na tabela.
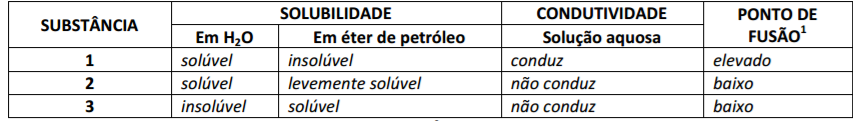
São considerados elevados, pontos de fusão acima de 150 ºC.
Com base nas informações apresentadas na tabela, é correto afirmar-se que
No que se refere às ligações químicas e à geometria molecular, julgue o item subsecutivo.
Na ligação covalente, dois pares de elétrons são
compartilhados por dois átomos. Na ligação iônica,
ocorre a repulsão entre as cargas opostas de ânions e
cátions.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Na ligação iônica, íons de diferentes elementos estão
unidos em um arranjo rígido, simétrico, resultante da
atração entre suas cargas opostas.
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Leia o fragmento a seguir.
Bomba de sódio-potássio: membrana citoplasmática regula a passagem de íons
Existem substâncias que devem estar presentes, em diferentes concentrações, dentro e fora das células. Por exemplo, as células humanas mantêm uma concentração interna de íons potássio (K+) cerca de 20 a 40 vezes maior que a concentração existente no meio extracelular. Por outro lado, a concentração de íons sódio (Na+) se mantém, no interior das nossas células, cerca de 8 a 12 vezes menor que a do exterior.
(Fonte: http://educacao.uol.com.br/disciplinas/biologia/htm)
Em relação aos elementos citados no texto, assinale a afirmativa correta.
Dados: número atômico do Na = 11. / número atômico do K = 19
A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
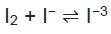
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
Marque a sequência correta.
“O enxofre ligado ao oxigênio consiste principalmente de sulfato de ésteres, como o sulfato de colina, sulfatos fenólicos e polissacarídeos e lipídios sulfatados. Essa fração constitui em média cerca de 50% do enxofre orgânico e é obtida pela reação do H2S com ácido iodídrico (HI).”
Fórmulas da colina e seu respectivo sulfato:
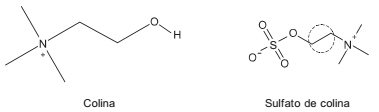
A ligação assinalada (no local pontilhado) é
Sobre as ligações químicas, analise as afirmativas.
I. A característica principal das ligações iônicas é a grande diferença de eletronegatividade entre os átomos. Um átomo deve ter baixa energia de ionização e o outro uma elevada afinidade eletrônica.
II. A atração eletrostática entre os íons na ligação iônica é a força mais significativa da estabilização da ligação.
III. A baixa energia de ionização necessária para uma ligação iônica é característica dos metais. A alta energia de afinidade eletrônica, que também é necessária para uma ligação iônica, é uma característica dos elementos químicos não metálicos, que necessitam de um, dois ou três elétrons para completar suas camadas de valência.
Está(ão) correta(s) a(s) afirmativa(s)