Questões de Concurso
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 341 questões
Na teoria da ligação pela valência, o átomo central em um complexo forma uma ligação covalente coordenada com cada ligante
no complexo, sendo os dois elétrons do par envolvido na ligação doados pelo ligante. Nesse caso, o átomo central utiliza um
conjunto apropriado de orbitais híbridos formados pela combinação de alguns de seus orbitais (n – 1)d, seu orbital ns, e alguns
de seus np. De acordo com essa teoria, a hibridização dos orbitais do íon Fe3+ (Z = 26) que recebem os elétrons dos ligantes,
no complexo 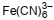 , é
, é
Sobre essas três espécies, segundo a Teoria do Orbital Molecular (TOM), tem-se que a(o)
I - Para algumas moléculas, a TLV considera a excitação de elétrons para um orbital de maior energia durante a formação da ligação química.
II - A TLV considera apenas a sobreposição de orbitais atômicos não hibridizados na formação da ligação sigma (σ).
III - A TLV utiliza o conceito de ressonância para explicar as ligações químicas em determinadas moléculas.
Está correto o que se afirma acima em:
I - O calor liberado na hidrogenação do benzeno é menor que o liberado na hidrogenação de um trieno não aromático.
II - O benzeno sofre reações de adição de bromo (Br2 ) nas suas duplas ligações.
III - Segundo a Teoria do Orbital Molecular (TOM), o benzeno possui três orbitais moleculares π ligantes preenchidos com elétrons, além de apenas um orbital molecular antiligante.
IV - Por possuir ligações duplas e simples, há ligações carbono-carbono com diferentes comprimentos no benzeno.
Está correto APENAS, o que se afirma em
HCℓ, KCℓ, MgCℓ2, CH2C ℓ2 e CC ℓ4.
Desses compostos, aqueles que apresentam ligação iônica são
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
A estrutura de Lewis para o íon tetrafluoroborato (BF4 − ) é a mostrada a seguir.
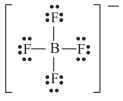
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis propôs a regra do
octeto.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis explicou o modelo
das ligações químicas.
Nesse experimento pode-se afirmar que houve um rompimento da ligação de
No que se refere às ligações químicas, à geometria molecular e a assuntos correlatos, julgue o item.
Pela teoria da repulsão entre os pares de elétrons da
camada de valência, é possível assegurar a orientação
dos pares eletrônicos de um átomo central, contudo a
geometria da molécula independe da posição entre os
pares eletrônicos da camada de valência.
No que se refere às ligações químicas, à geometria molecular e a assuntos correlatos, julgue o item.
Ocorre uma ligação covalente coordenada quando a
ligação é formada entre um ácido de Lewis e uma base
de Lewis, pelo partilhamento de um par de elétrons
originalmente pertencente ao ácido de Lewis.
No que se refere às ligações químicas, à geometria molecular e a assuntos correlatos, julgue o item.
A ligação química é uma interação instável entre átomos
de características semelhantes, podendo ser do tipo
ligação covalente, ligação iônica ou ligação metálica.
Acerca da estrutura atômica da matéria e dos métodos de separação e de composição das misturas, julgue o item.
Para um composto iônico, a fórmula unitária é composta
por um grupo de íons cuja fórmula é igual à fórmula da
menor unidade de um composto iônico.
Via de regra, os aços mais dúcteis, largamente utilizados em elementos estruturais e tubulações, são aços:
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

O fato de o NaCl fundir-se a 801 °C e o MgO fundir-se a 2.852 °C é uma evidência de que os sólidos iônicos são unidos por interações entre cátions e ânions, isto é, ligações iônicas.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Os sólidos iônicos são cristalinos, e os sólidos moleculares são amorfos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

As moléculas se organizam por meio de ligações covalentes entre si para formar os sólidos moleculares.
Uma das principais vantagens da teoria de ligação de valência é a possibilidade de explicar, satisfatoriamente, fenômenos associados a estados de excitação e de prever os espectros de absorção e emissão de energia eletrônica das moléculas.
Nos compostos formados por cátions e ânions muito polarizáveis, o caráter da ligação química é fortemente covalente.