Questões de Concurso
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 338 questões
Fonte:http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_ligacoes_quimicas.pdf
Sobre as propriedades gerais associadas a compostos iônicos e covalentes, pode-se afirmar que
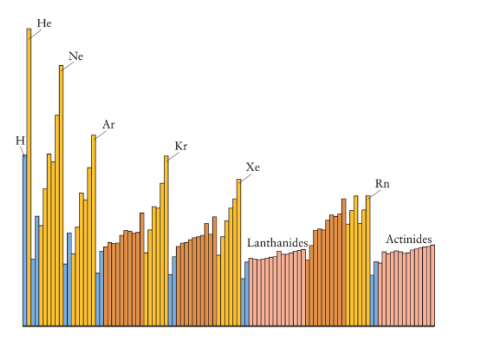
De acordo com a tendência geral das propriedades periódicas, a propriedade apresentada na figura acima poderia ser
Dentre as opções a seguir, o recheio para coluna cromatográfica que apresenta uma interação covalente é
I. Ligação química forte, covalente, existente entre os átomos de alumínio e oxigênio. II. Ligação química forte, metálica, existente entre os átomos de alumínio e oxigênio. III. Ligação química forte, iônica, existente entre os átomos de alumínio e oxigênio.
Está CORRETO apenas o que se afirma em:
"Os átomos tendem a ganhar, perder ou compartilhar elétrons até que tenham oito elétrons (octeto) no último nível de energia, ou dois elétrons (dubleto) quando possuem apenas o primeiro nível de energia."
Essa regra foi proposta em 1916 por Gilbert Newton Lewis, que foi um dos maiores químicos do século XX. Atualmente, já se sabe que a explicação dos diferentes tipos de ligação química é bem mais complexa, existindo centenas de compostos nos quais o octeto não é obedecido. A desobediência dessa teoria pode ser observada no seguinte composto
A ligação covalente é a união que ocorre entre os átomos depois que um dos átomos transfere definitivamente elétrons a outro átomo. Desse modo, ocorrem, na substância, interações moleculares bastante fortes, mantendo os átomos firmemente presos. Os compostos moleculares, em geral, são sólidos nas condições ambientes.
Uma forma comum de os átomos obterem estabilidade química é por meio da ligação iônica, união entre os átomos que se estabelece por meio do compartilhamento de pares de elétrons; tais compostos iônicos, em geral, são sólidos e apresentam altos pontos de fusão e ebulição.

Considerando essas informações, assinale a opção correta.
Com base nos valores de eletronegatividade da escala de Pauling, prevê-se que a ligação química com maior caráter iônico é encontrada na molécula
Dados:
Eletronegatividade de Pauling:
H = 2,2
C = 2,55
N = 3,04
O = 3,44
Cℓ = 3,16
Br = 2,96
Na teoria da ligação pela valência, o átomo central em um complexo forma uma ligação covalente coordenada com cada ligante
no complexo, sendo os dois elétrons do par envolvido na ligação doados pelo ligante. Nesse caso, o átomo central utiliza um
conjunto apropriado de orbitais híbridos formados pela combinação de alguns de seus orbitais (n – 1)d, seu orbital ns, e alguns
de seus np. De acordo com essa teoria, a hibridização dos orbitais do íon Fe3+ (Z = 26) que recebem os elétrons dos ligantes,
no complexo 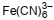 , é
, é
Sobre essas três espécies, segundo a Teoria do Orbital Molecular (TOM), tem-se que a(o)
