Questões de Concurso
Sobre propriedades coligativas: tonoscopia, ebulioscopia, crioscopia e pressão osmótica. em química
Foram encontradas 83 questões
Frasco A: REAÇÃO A : H2(g) + I2(g) ⇌ 2HI(g)
Frasco B: REAÇÃO B: 2NO2(g) ⇌ 2NO(g) + O2(g)
Considere os gases como ideias.
Se o volume de cada frasco for reduzido para um terço do volume inicial, é possível observar que:
A partir das informações do texto precedente, julgue o próximo item.
A água salgada residual presente no petróleo contendo sais
minerais dissolvidos possui ponto de ebulição menor que o
da água destilada à mesma pressão.
Algumas substâncias em soluções podem modificar o ponto de ebulição ou de congelamento em relação ao solvente puro. “A redução do ponto de congelamento e o aumento do ponto de ebulição são propriedades físicas das soluções que dependem da quantidade (concentração), mas não do tipo ou identidade das partículas do soluto. Tais propriedades são chamadas propriedades coligativas”. Considerando o ponto de congelamento do etanol igual a -114,6 °C e, para essa temperatura, a constante crioscópica (Kc) 1,99 °C.mol. kg-1, o ponto de congelamento de uma solução contendo 0,5 kg de C2H5OH e 77 g de eucaliptol (C10H18O), uma substância encontrada na folha do eucalipto, será:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005)
A imagem a seguir apresenta, de forma resumida, um procedimento experimental comum na análise de água, avalie-o.
Resultado em mg/L CaCO₃
O processo experimental começa com a diluição da amostra e o ajuste do pH por meio de solução tampão. Em seguida, adiciona-se 0,05g do indicador Negro de Eriocromo T (NET) à solução, para posterior titulação com ácido etilenodiamino tetra-acético (EDTA) até alcançar o ponto final da titulação. O procedimento experimental e os reagentes apresentados na imagem e na descrição atuam na determinação de(a):
A temperatura de ebulição dessa solução sob pressão atmosférica é
Dado
constante ebuliométrica do etanol = 1,22 ºC kg mol-1 massas molares: C = 12 g mol-1, H = 1 g mol-1, O = 16 g mol-1
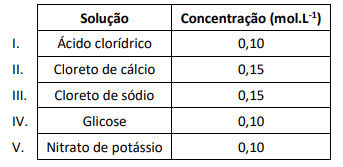
A solução que apresenta o menor efeito crioscópico é a
O quadro a seguir apresenta as concentrações de cinco soluções ideais obtidas com diferentes solutos totalmente dissociados.
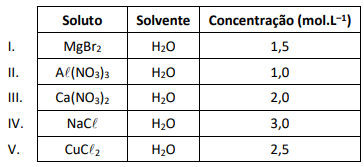
A solução que apresenta a menor pressão de vapor é a
(Fonte: https://www.cnnbrasil.com.br/saude/empresa-de-petiscos-para-animaissuspende-venda-por-contaminacao-por-etilenoglicol/, data de publicação: 19/10/2022; consultado em: 23/12/2022).
Recentemente essa e outras notícias similares veiculadas nas mídias alertaram a população sobre a contaminação de produtos para animais por etilenoglicol, um solvente orgânico altamente tóxico que causa insuficiência renal e hepática, podendo levar à morte, quando ingerido.
Apesar de sua alta toxicidade, ele é usado em diversos processos industriais em que a refrigeração a temperaturas próximas ou levemente inferiores a 0oC é necessária. Nessa temperatura, a água pura congelaria sob pressão atmosférica. Misturas água / etilenoglicol, entretanto, se mostram líquidas nessas condições.
Sobre a mudança de temperatura de congelamento da mistura, em relação à do solvente, é correto afirmar que o etilenoglicol
Em cinco béqueres, numerados de 1 a 5, foram preparadas separadamente cinco soluções saturadas, cada uma delas com 200g de água destilada, a 50oC, e os sais descritos no quadro a seguir.
Béquer |
Sal |
1 |
Nitrato de chumbo (II) |
2 |
Nitrato de potássio |
3 |
Cloreto de potássio |
4 |
Dicromato de potássio |
5 |
Clorato de potássio |
A figura apresenta as curvas de solubilidade desses sais.
(TRO, Nivaldo, J. Química uma abordagem molecular, LTC, Rio de Janeiro, 2017 Adaptado)
As soluções foram resfriadas e mantidas a 20o C. Nessa temperatura, foram observados cristais (corpo de fundo) em todos os béqueres.
O béquer que apresentou maior massa de sal cristalizado na solução a 20o C foi o de número
A água dura existente em tubulações de caldeiras contém sais dissolvidos como o Ca(HCO3)2 e Mg(HCO3)2 que, por aquecimento, se decompõem. Por essa reação, formam-se substâncias que com o tempo diminuem a seção da tubulação, ficando aderidas nas paredes.
...
A propriedade que justifica o comportamento descrito está relacionada a:
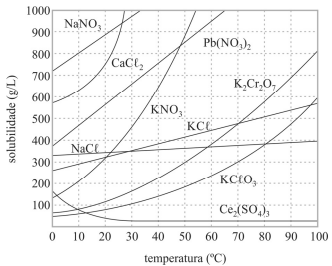
Todos os compostos referenciados no gráfico apresentado são iônicos e apresentam elevadas temperaturas de fusão e ebulição.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A água, quando está a 25 ºC, tem pressão de vapor igual a 3 172 Pa. Adicionando-se açúcar à água, a pressão de vapor irá sofrer um ..I.. , que se observa na ..II.. da temperatura de ebulição.
Preenchem as lacunas I e II, correta e respectivamente,
O valor mais próximo da pressão de vapor dessa solução, em mmHg, é
Dado: Pressão de vapor do etanol puro = 44 mmHg a 25º C Pressão de vapor da água pura = 18 mmHg a 25º C M (água) = 18,00 g mol-1 M (etanol) = 46 g mol-1
A Resolução CONAMA 430/2011, que alterou e completou a Resolução CONAMA 357/2005, estabelece que os efluentes de qualquer fonte poluidora somente poderão ser lançados diretamente no corpo receptor desde que obedeçam a remoção mínima de 60% de sua DBO. A DBO corresponde à quantidade de oxigênio dissolvido em um litro de água (mgO2/L) que será consumida por microrganismos na degradação biológica de matéria orgânica. A presença de oxigênio dissolvido na água é de extrema importância na manutenção dos organismos aeróbios como os peixes.
Apesar de o gás O2 corresponder a quase 21% do volume da nossa atmosfera, sua concentração na água é pequena, estando na faixa das partes por milhão (ppm).
Lembre que o oxigênio se dissolve na água de acordo com o que estabelece a Lei de Henry
CX(aq) = KH × PX
em que CX(aq) é a concentração do gás X na água em mol/L, KH é uma constante dada em ( mol / L.atm) e PX é a pressão parcial do gás X na interface com a água, dada em atm.
Leve em consideração que a relação entre a pressão do gás e a pressão total da mistura gasosa sempre será igual à fração em quantidade de matéria do gás em questão (Lei de Dalton).
Assim, a concentração em ppm de O2 dissolvido na água na
temperatura de 20ºC e pressão de 1 atm, levando em
consideração que a KH para o O2 dissolvido é de 1,3x10-3 mol /L.atm e a
massa molecular para o O2 é de 32 g/mol, é igual a
A densidade do aço é maior do que a densidade da água. Por isso, ao se colocar uma colher de aço em um recipiente com água, ela afundará. Todavia, ao se colocar cuidadosamente uma agulha de aço, na horizontal sobre a superfície da água, ela não afundará.
É possível explicar esse fenômeno por meio da
Diante do exposto, assinale a alternativa correta.