Questões de Concurso Comentadas sobre química
Foram encontradas 7.276 questões
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
“Além do ácido sulfúrico, o Falso Geber descreveu também como fazer ácido nítrico forte.”
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Os métodos usados por alquimistas, ainda que rudimentares, permitiram o isolamento de ácidos acético, lático, sulfúrico e nítrico. O último, conhecido na época como água forte, se destacava pela “assombrosa capacidade de dissolver quase tudo, exceto ouro”.
[Dados: Potenciais de Redução Padrão:
2H+ + 2e- → H2 E0 = 0,00 V NO3- + 4H+ + 3e- → NO + 2H2O E0 = 0,96 V NO3- + 2H+ + e- → NO2 + H2O E0 = 0,80 V Cu2+ + 2e → Cu E0 = 0,34 V]
Tomando o cobre como exemplo, a capacidade do ácido nítrico dissolver esse metal deve ser, à luz do conhecimento atual, justificada pela
A sequência de reações que ocorrem no momento da coleta é:
• Mn2+ + 2 OH- → Mn(OH)2 • 2Mn(OH)2 + O2 → 2 MnO(OH)2
Já no laboratório, a solução é acidificada e o precipitado édissolvido:
• MnO(OH)2 + 4 H+ → Mn4+ + 3 H2O • Mn4+ + 2 I- → Mn2+ + I2
O iodo formado é titulado com tiossulfato permitindo adeterminação do O2.
Nesta sequência de reações, 1 mol de I2titulado equivale a
MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014
Neste texto, Machado critica o uso dos níveis de conhecimento que podem ser usados no ensino de Química.
Para atingir um balanço mais adequado entre os níveis, o professor poderia adotar em sua sala de aula
Embora os fosfatos não apresentem toxicidade elevada, são excelentes nutrientes e favorecem a proliferação excessiva de algas e cianobactérias. Esse fenômeno é chamado eutrofização.
A esse respeito, assinale a afirmativa incorreta.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
0,700g de amostra foi digerido e alcalinizado com excesso de solução de hidróxido de sódio. Após destilação, a amônia foi coletada em 25,00mL de solução de ácido sulfúrico 0,0750mol L–1. A titulação do excesso do ácido requereu 5,00mL de solução de hidróxido de sódio 0,1250 mol L–1.
[Dados: Massa molar do nitrogênio = 14 g mol–1.]
O teor de nitrogênio na amostra é de
Assinale a alternativa que apresenta apenas compostosaromáticos:
O preparo de uma solução envolveu as seguintes etapas:
1. Transferência de 5,0mL de solução aquosa de cloreto de magnésio 1,90 g L-1 a balão volumétrico de 25,0mL.
2. Adição de 10,0mL de solução aquosa de sulfato de sódio 0,015 mol L-1 ao mesmo balão.
3. O volume da solução final no balão volumétrico foi completado à 25,0mL como água destilada.
[Dados: massas molares (em g.mol–1 ). Mg: 24; Cl: 35,5; Na: 23; S: 32; O: 16.]
A concentração total de cátions, em mol L–1, na solução final será
de
(Fonte: https://www.cnnbrasil.com.br/saude/empresa-de-petiscos-para-animaissuspende-venda-por-contaminacao-por-etilenoglicol/, data de publicação: 19/10/2022; consultado em: 23/12/2022).
Recentemente essa e outras notícias similares veiculadas nas mídias alertaram a população sobre a contaminação de produtos para animais por etilenoglicol, um solvente orgânico altamente tóxico que causa insuficiência renal e hepática, podendo levar à morte, quando ingerido.
Apesar de sua alta toxicidade, ele é usado em diversos processos industriais em que a refrigeração a temperaturas próximas ou levemente inferiores a 0oC é necessária. Nessa temperatura, a água pura congelaria sob pressão atmosférica. Misturas água / etilenoglicol, entretanto, se mostram líquidas nessas condições.
Sobre a mudança de temperatura de congelamento da mistura, em relação à do solvente, é correto afirmar que o etilenoglicol
Considere as reações de P4O10 incompletas e não balanceadas:
I. P4O10 + a KOH → b K3PO4 + c H2O II. P4O10 + d HClO4 → e X + f H3PO4
A esse respeito, é correto afirmar que
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
A Cipermetrina é uma substância do grupo dos piretróides e possui classificação toxicológica nível II (altamente tóxica). É fotoestável, não se degradando com a luz solar. Atua como um potente inseticida, por contato ou ingestão, contra alvos biológicos que causam consideráveis danos a culturas como algodão, café, milho e soja.
A fórmula que representa a estrutura química da cipermetrina é mostrada a seguir.
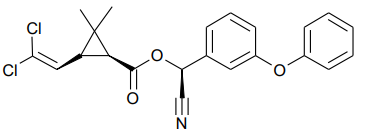
Nessa estrutura, é possível identificar os grupos funcionais
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
1. A quantização do momento angular. 2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Hidroxiacetona, etanoato de metila e ácido propanoico são isômeros. ( ) Hidroxiacetona, etanoato de metila e ácido propanoico apresentam grupos polares em suas estruturas. ( ) Pontos de ebulição dos compostos seguem a ordem: etanoato de metila > ácido propanoico ≈ hidroxiacetona.
As afirmativas são, respectivamente,
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
[Dados: massas molares (em g.mol-1). Metano: 16; Amônia: 17.]
Nesse caso, é correto afirmar que os recipientes contêm
A análise elementar de uma amostra revelou a seguinte composição: 58,5% de carbono, 4,1% de hidrogênio e 11,4 % de nitrogênio.
[Dados: massas molares (em g.mol-1): C: 12; H: 1; N: 14; O: 16.]
A fórmula mínima do composto na amostra é