Questões de Concurso Comentadas sobre química
Foram encontradas 7.277 questões
Um pesquisador solicitou a um técnico que preparasse soluções de sais de sódio utilizando os ácidos listados na tabela a seguir com uma concentração inicial de 0,500 M.
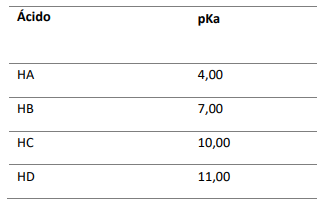
Nessa situação, a solução que terá o pH mais alto e será a mais básica é(são)
A titulação de um ácido forte e uma base fraca pode ser ilustrado pela reação do HCl e NH₄OH, conforme representada abaixo:
HCl + NH₄OH ⇄ NH₄Cl + H₂O
Assinale a alternativa que apresente corretamente o indicador mais apropriado para a titulação.
A concentração de íon sulfato em água natural pode ser determinado medindo-se a turbidez que resulta quando um excesso de BaCl₂ é adicionado a uma quantidade determinada de amostra. Um turbidímetro, o instrumento usado para esta análise, foi calibrado com uma série de soluções padrão de Na₂SO₄. Os dados que seguem forma obtidos na calibração:
|
ppm de |
Leitura do turbidímetro, R |
0,00 |
1,96 |
5,00 |
1,91 |
10,00 |
1,88 |
15,0 |
1,94 |
Com base na tabela, considerando os dados da leitura do turbidímetro, à média, o desvio-padrão absoluto e o coeficiente de variação para os dados, são, respectivamente,
Durante uma análise espectroscópica de absorção molecular no UV/Vis, um pesquisador estava investigando a concentração de uma solução de um corante desconhecido. Ele preparou soluções de concentrações conhecidas do corante e registrou os espectros de absorção para cada uma delas. Após analisar os dados, ele observou que a relação entre absorbância e concentração não era linear. Em vez disso, ele notou um aumento exponencial na absorbância com o aumento da concentração.
Tomando como base a interação do corante com a luz na faixa do UV/Vis, assinale a alternativa correta.
O produto de solubilidade dos compostos é de grande importância na química analítica, pois, com seu auxílio, é possível não só explicar como também prever as reações de precipitação. Ele também tem importantes aplicações no tratamento de esgoto sanitário, na extração de minerais da água do mar, na formação e perda de ossos e dentes e no ciclo global do carbono.
(ATKINS, P.W.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente, 5ª Edição, 2011.)
A respeito do produto de solubilidade, analise as afirmativas a seguir:
I. A constante do equilíbrio entre um sólido e seus íons dissolvidos é chamada de produto de solubilidade, Kps, do soluto.
II. A constante do produto de solubilidade, Kps para uma solução saturada de Ca(IO3)2 em água é Kps= [Ca+2][IO-3].
III. O produto de solubilidade Kps para o sal de prata AgX é 4,0 x 10-8. A solubilidade molar do AgX em água é 2,0 x 10-4 mol L-1.
IV. A comparação dos valores de Kps não pode ser usada para prever a ordem de precipitação de sais que apresentam a mesma proporção estequiometria entre cátion e ânion.
Está correto apenas o que se afirma em
“A base da análise gravimétrica é a pesagem de uma substância obtida pela precipitação de uma solução, ou volatizada e subsequentemente absorvida.” (MENDHAM, J. et al. VOGEL, Análise Química Quantitativa. 6. ed. RIO DE JANEIRO: LTC, 2002.)
Considerando os princípios que determinam o sucesso de uma análise por precipitação, assinale a afirmativa incorreta.
O etanol é uma substância química, de fórmula C2H6O, pertencente à função orgânica dos álcoois. Comercialmente, é conhecido como álcool etílico, sendo um líquido incolor, inflamável e miscível em água. Possui diversas aplicações industriais, dentre elas como solvente e na produção de bebidas alcoólicas. O etanol é considerado um:
A ética na prática da química é fundamental para garantir a segurança, responsabilidade e integridade dos profissionais. Qual das seguintes ações é um exemplo de conduta ética em um laboratório químico?
Considere uma reação química genérica representada por aA+bB→cC+dD, onde A e B são reagentes, e C e D são produtos. Se a velocidade de uma reação é diretamente proporcional à concentração de A elevada ao quadrado (A²) e à concentração de B, qual é a ordem de reação em relação a A e B?
Um químico tem acesso a um vidro âmbar contendo HCl 0,1 M. Isso significa que essa solução contém:
Qual dos seguintes temas abaixo é abordado pela Portaria GM/MS Nº 888?
Qual é o nome sistemático do seguinte composto orgânico CH3CH2CH2CH3?
Qual é o nome do ânion poliatômico SO42−?
Se 2 mols do composto X2Y3Z4 forem fornecidos, quantos átomos de Y estarão presentes nesses 2 mols?
Qual é um indicador de pH comumente utilizado em titulações ácido-base que muda de cor na faixa de pH adequada para essa titulação?
Se 25.0 mL de uma solução de NaOH requerem 30.0 mL de HCl a 0.1 M para atingir o ponto de equivalência, qual é a concentração do hidróxido de sódio?
Qual é o indicador bacteriano frequentemente encontrado na análise de tubos múltiplos que indica contaminação fecal?
Considere a análise bacteriológica de tubos múltiplos para avaliar a qualidade microbiológica da água. Qual é o princípio fundamental da análise bacteriológica de tubos múltiplos?
Considere os seguintes elementos: carbono (C), oxigênio (O) e hidrogênio (H). Com base nas propriedades de ligação química, escolha a opção CORRETA:
Observe a molécula de Ácido Acetilsalicílico (C9H8O4) abaixo e responda: Quantos carbonos terciários existem nessa molécula?