Questões de Concurso Sobre química
Foram encontradas 14.093 questões
Sobre massa molar e dada a distribuição hipotética a seguir, é correto afirmar:
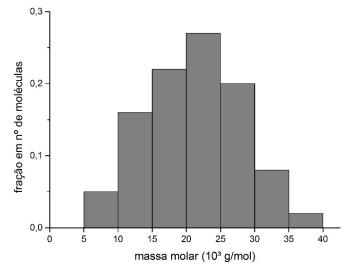
CALLISTER JR., W. D.; RETHWISCH, D. G. Ciência e engenharia de materiais: uma introdução. 8. ed. Rio de Janeiro: LTC, 2012, p. 462.
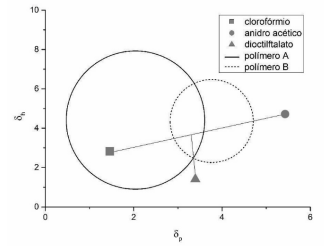
Com base nas informações e no gráfico apresentado, é correto afirmar:
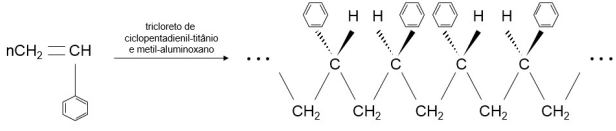
Analisando o intervalo da estrutura do poliestireno gerado, é correto afirmar que se trata de uma configuração tipo:
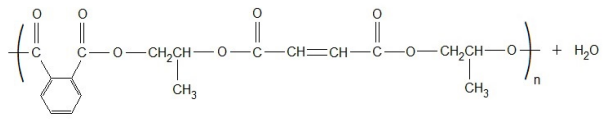
Analisando exclusivamente a fórmula estrutural do PPPM, o número de átomos de carbono secundário (C) e de hidrogênio (H) constituintes são, respectivamente:
I. Não existe nenhuma recomendação ou norma que estabeleça o tipo de calçado a ser utilizado no laboratório, permitindo-se inclusive sandálias, contanto que estejam sendo usadas meias longas e grossas. II. É proibido comer, beber ou fumar no interior dos laboratórios. III. Durante realização de atividade em laboratório, é vedado o uso de adornos pessoais (relógio, aliança, correntes, piercing, etc.).
Quais estão corretas?
Coluna 1 1. Cloro. 2. Hidrocarbonetos. 3. Peróxido de hidrogênio. 4. Líquidos inflamáveis. 5. Metais alcalinos.
Coluna 2 ( ) Dióxido de carbono, tetracloreto de carbono, halogênios, hidrocarbonetos clorados e água.
( ) Cromo, cobre, ferro, metais, substâncias orgânicas, substâncias combustíveis (sólidas e líquidas).
( ) Nitrato de amônio, peróxido de sódio, peróxido de hidrogênio, ácido nítrico e halogênios.
( ) Acetona, acetileno, amônia, benzeno, butadieno, butano e outros gases de petróleo, hidrogênio, metais em pó, carboneto de sódio e terebentina.
( ) Flúor, cloro, bromo, peróxidos de sódio e de hidrogênio, ácido crômico, percloratos e outros oxidantes fortes.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
I. Alumínio-trimetil, sódio e potássio. II. Lítio, bromo e alumínio. III. Dietil-zinco, butil-lítio e alumínio-dietil cloreto. IV. Alumínio-etil sesquicloreto, cromo e alumínio-etil dicloreto.
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
(Dados, em g/mol; H=1, S=32 e O=16; log 2=0,3)
(Dados em g/mol: Na= 23, O = 16, H = 1)