Questões de Concurso Sobre química
Foram encontradas 14.093 questões

Disponível em: https://acervodigital.ufpr.br/ bitstream/handle/1884/54706/R%20%20D%20%20CAMILLA%20MARIANE%20MENEZES%20SOUZA.pdf?sequence=1&isAllowed=y.
Referente à figura, é correto afirmar que se trata de um ácido graxo:
Coluna I 1. Possui caráter básico. 2. Em solução aquosa se ioniza. 3. Obtém-se na reação de neutralização. 4. Utilizado pelas plantas na fotossíntese.
Coluna II
( ) Sulfato de potássio ( ) Cloreto de hidrogênio ( ) Hidróxido de magnésio ( ) Gás carbônico
A sequência correta, de cima para baixo, é:

( ) O ácido bromídrico (HBr) é um hidrácido forte. ( ) O ácido fosfórico (H3PO4) é um oxiácido forte. ( ) O ácido hipocloroso (HCℓO) é um oxiácido fraco. ( ) O ácido iodídrico (HI) é um hidrácido fraco.
Está correta, de cima para baixo, a seguinte sequência:


Uma das formas da obtenção do gás nitrogênio é através da reação química do sódio com o nitrato de potássio. Sua equação química, não ajustada, é:
Na(s) + KNO3(s) → K2O(s) + Na2O(s) + N2(g).
Assinale a opção que corresponde aos coeficientes do par
das substâncias, reagente e produto.

I. A química transformou as comunicações e os transportes: forneceu materiais avançados, como o cobre para computadores e o silício para fibras óticas.
II. A química trata da matéria e suas transformações, tanto no nível macroscópico como no nível microscópico.
III. A química e sua indústria tiveram que evoluir juntamente com o mundo para se tornar sustentável, surgindo a química verde.
É correto o que se afirma em
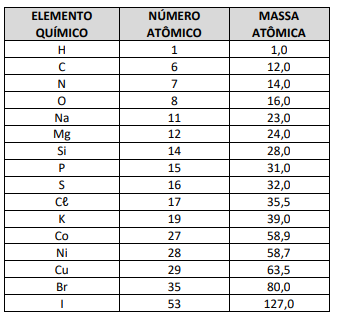
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
A ordem crescente de pKaH é:
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
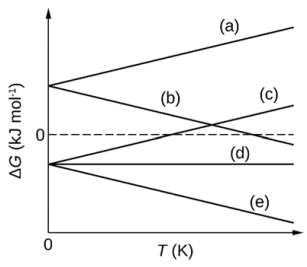
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de:

Entre os compostos listados, verifica-se maior perigo associado à espécie:
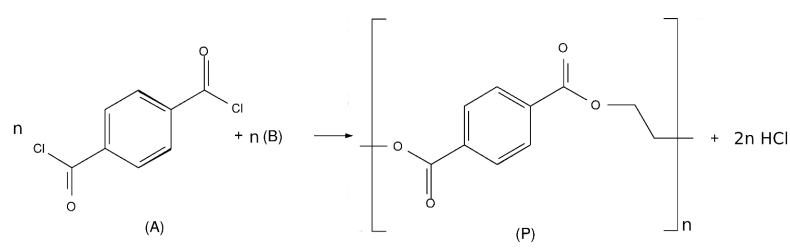
Para obtenção do produto (P), o derivado de cloreto de acila (A) deve reagir com o reagente (B), que é o:
Dados: N (Z=7); O (Z=8)
N2O(g) + O3(g) ⇌ N2O4(g) K = 4,4 × 102
Num sistema em equilíbrio, as concentrações de O3 e N2O4 são, respectivamente, 6,4 x 10-3 mol L-1 e 0,25 mol L-1. Qual é o valor da concentração de N2O?
NO(g) + O3(g) → NO2(g) + O2(g)
Dados cinéticos dessa reação obtidos a T = 298 K foram medidos por técnica de fluxo rápido; alguns desses dados constam no quadro a seguir.

A lei da velocidade para a reação mencionada é: