Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Considere a imagem a seguir para a resolução da questão:
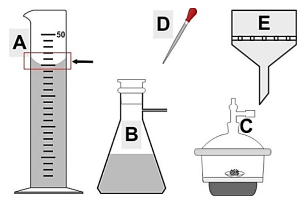
Considere a imagem a seguir para a resolução da questão:

Considere a imagem a seguir para a resolução da questão:

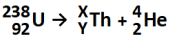
Considerando o exposto, os valores de X e Y (relativos ao tório) são, respectivamente:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Após o balanceamento, a somatória dos menores coeficientes estequiométricos (números inteiros) para a reação química apresentada será de:
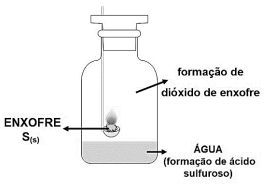
Certa quantidade de enxofre é inserida no dispositivo de combustão e a chama é iniciada no bico de Bunsen. Então, ainda com a chama acesa, o dispositivo é inserido em um frasco hermeticamente fechado e o dióxido de enxofre formado fica confinado no recipiente. Este gás, por sua vez, reage com a água contida no fundo do frasco, formando uma solução de ácido sulfuroso. Considerando todas as informações apresentadas e a imagem, a reação que expressa corretamente a formação do ácido sulfuroso é:
Se a ANM se comportar como um vaso perfeitamente adiabático, não ocorrerá trocas de calor entre ela e o meio externo.
A temperatura de fusão da parafina independe da pressão à qual ela está submetida.
É desejável que uma ANM tenha alta condutividade térmica, sendo importante o estudo da curva de resfriamento em vários pontos da árvore quando ocorre o desligamento do escoamento quente.
Hidrocarbonetos são moléculas formadas por átomos de carbono e hidrogênio, as quais podem ser saturadas, como no caso dos alcanos, ou insaturadas, como no caso dos alcenos e alcinos.
No processo de fracionamento do petróleo, os hidrocarbonetos mais voláteis chegam ao topo da coluna e os menos voláteis não conseguem chegar lá, acumulando-se nos diversos níveis da coluna.
O hidrocarboneto de fórmula H2C=CH−CH=CH2 pertence à classe dos alcadienos.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
O processo de soldar a arco elétrico com eletrodo revestido é
mais sensível às correntes de ar que outros processos de
soldagem com proteção gasosa, como a TIG.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Em uma soldagem com eletrodo revestido, o elevado ponto
de fusão do tungstênio permite a aplicação desse metal como
eletrodo não consumível.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
O tipo de corrosão mais comum nas tubulações e
equipamentos industriais é a eletroquímica, na qual um
componente oxida, ou seja, ganha elétrons, e o outro reduz,
ou seja, perde elétrons.