Questões de Concurso Sobre química
Foram encontradas 14.919 questões

Nos termos da Associação Brasileira de Normas Técnicas – ABNT NBR 7500, o símbolo indica tratar-se de substância:

Segundo a Associação Brasileira de Normas Técnicas – ABNT NBR 7500, o símbolo apresentado na imagem indica substância:
Considere a imagem a seguir:

Segundo a Associação Brasileira de Normas Técnicas –
ABNT NBR 7500, o(s) símbolo(s) utilizado(s) para indicar produtos químicos com propriedades oxidantes encontra(m)-se
identificado(s) pelo(s) número(s)
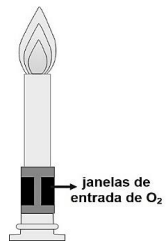
I. As janelas de entrada abertas favorecem a chama oxidante, cuja coloração é tipicamente azul.
II. As janelas de entrada fechadas favorecem a chama redutora, a qual demostra coloração amarela em situações reais.
III. A chama redutora tem temperatura maior comparada à oxidante. Por isso, é a mais utilizada nas análises químicas e nos ensaios com micro-organismos para a manutenção do ambiente estéril.
Está correto o que se afirma em
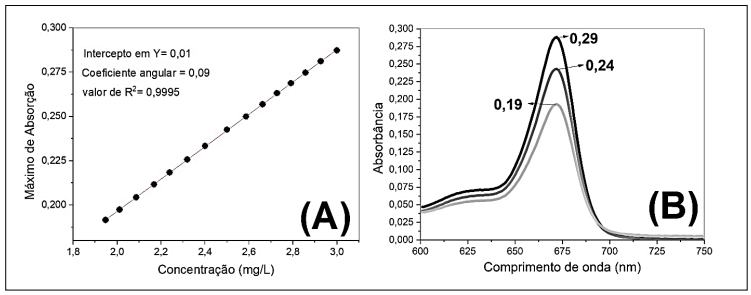
Considerando a curva de calibração (e seus dados para obtenção da equação de regressão), o valor de concentração (mg/L) média da substância APB na água de lavagem será de:
A imagem apresenta um microscópio óptico:
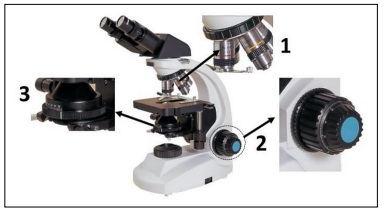
Considerando os componentes 1, 2 e 3 destacados na
imagem, assinale a afirmativa INCORRETA.
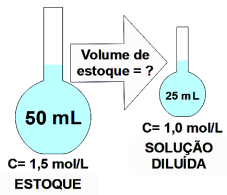
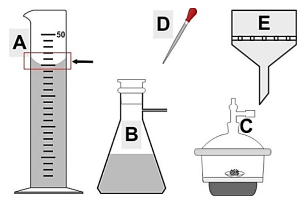
O volume do estoque necessário para o preparo da solução diluída será, aproximadamente, de:
I. Uma solução padrão tem concentração conhecida exatamente; pode ser obtida com o uso de padrões primários.
II. Normalmente, as substâncias padrão primário apresentam água de hidratação.
III. Todo padrão primário deve ser submetido a análise química para determinação da sua concentração real.
Está correto o que se afirma apenas em
( ) Chinelos e sandálias no laboratório de química são permitidos. ( ) É proibido beber e comer no laboratório. ( ) Gravatas e lenços atados ao pescoço são proibidos no laboratório. ( ) Cabelos longos podem permanecer soltos, desde que não atrapalhem a visão. ( ) É recomendado o uso de roupas e jalecos de natureza sintética.
A sequência está correta em

O volume necessário de ácido clorídrico concentrado requerido para o preparo da solução será, aproximadamente, de:
Considere a imagem a seguir para a resolução da questão: